(révision du 6 juin 2019)
Cahier de texte numérique
cliquez ici pour aller directement au bas de cette page
PRÉSENTATION DU PROGRAMME DE SCIENCES PHYSIQUES EN 1èreS (inspection académique) : Présentation Programme 1S
mercredi 5 septembre
PARTIE 1 :
IMAGES ET COULEURS
séquence 1
VISION ET IMAGE
objectif 1 : décrire le modèle de l'oeil
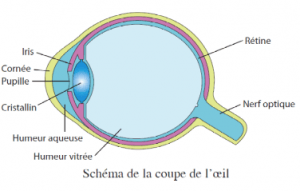
jeudi 6/09/18
objectif 2 : construire l'image d'un objet
animations
- formation d’une image dans l’oeil
- formation d’une image par une lentille convergente
- formation d’une image sur un écran
mercredi 12/09
Construction géométrique d’un objet : notion d’image virtuelle
formation d’une image dans l’oeil
jeudi 13/09
Un peu de mathématiques : notion de valeurs algébriques
exercices 21 et 22 p 27 (sauf les questions de calcul)
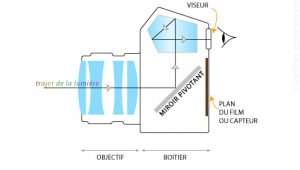
animation : mise au point d’un appareil photo (attendez un peu que l’animation charge…)
objectif 3 : utiliser les relations de conjugaison et de grandissement
activité p 19
utiliser la fiche méthode 7
mercredi 19/09/18
correction de l’activité :
RELATION DE GRANDISSEMENT
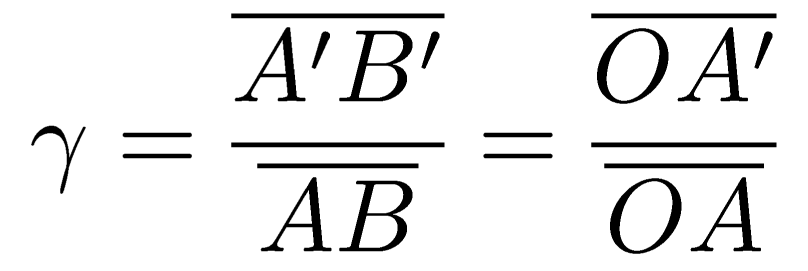
RELATION DE CONJUGAISON
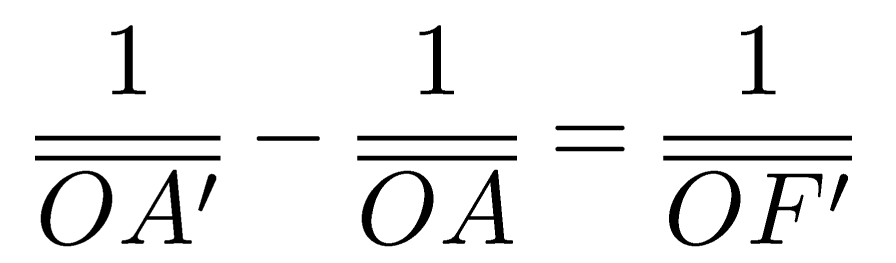
Pour jeudi 20/09/18 : retrouver grâce à ces relations les valeurs de OA’ et de A’B’ trouvées géométriquement dans cette situation :
Un objet AB de 2 cm se trouve à 6 cm d’une lentille de distance focale égale à 2 cm.
jeudi 20/09
utilisation des relations de conjugaison et de grandissement
jeudi 20/09
ex 21 + 22 p 27
Séquence 5
INTRODUCTION À LA
CHIMIE DES COULEURS
Objectif 3 : Réaliser une extraction et une séparation par chromatographie
TP : Le Lycopène est responsable de la couleur rouge des tomates.Est-il également responsable de la couleur du paprika ?

mercredi 26/09
correction de l’ex 21p27
- la vergence est C = 1/f = 50 δ
- on obtient un grandissement γ = -1
l’ex 22 p 27 est corrigé (voir p461)
(attention à la signification mathématique des valeurs algébriques : elles peuvent être positives ou négatives.)
pour mercredi 3/10/18 : ex 25 p 27 (les ex 26 et 27 p 28, corrigés dans le manuel, doivent avoir été traités)
Le chapitre est terminé !
Vous devrez vérifier que vous avez atteint les objectifs du chapitre. Vous pouvez parfaire votre maitrise grâce aux exercices corrigés.
Utilisez la fiche D’AUTOEVALUATION pour faire le point
jeudi 27/09/18
séquence 2
VISION ET COULEURS
(source : http://www.daltonisme.com/)
objectif 1 : Décrire la perception des couleurs par l'oeil
la perception des couleurs est assurée par 3 types de cônes, sensibles respectivement aux couleurs bleue, vert et rouge.
ANIMATION : COULEUR DES OBJETS (rappel du collège)
objectif 2 : Comprendre la formation d'une lumière colorée
objectif 3 : Interpréter la couleur des objets.
TP – COMMENT SE FORMENT LES COULEURS – INTERPRETER LA COULEUR DES OBJECTS
Animation : La synthèse additive – la synthèse soustractive des couleurs
mercredi 03/10
correction de l’ex 25p27 : on trouve γ = -1,0.10-2 et A’B’ image inversée de 4,0 mm sur la pellicule.
ex 14 p 40 et 23 p 41
(correction des exercices : ex-14p41-et-23p41)
jeudi 04/10
séquence 3
SOURCES DE LUMIÈRE COLORÉE
objectif 1 : Connaitre les différentes sources de lumière colorée
activité 1 p 46
objectif 2 : Comprendre la notion de lumière colorée
activité 2 p 47
objectif 3 : Exploiter la loi de Wien
La couleur des corps chauffés dépend de la température
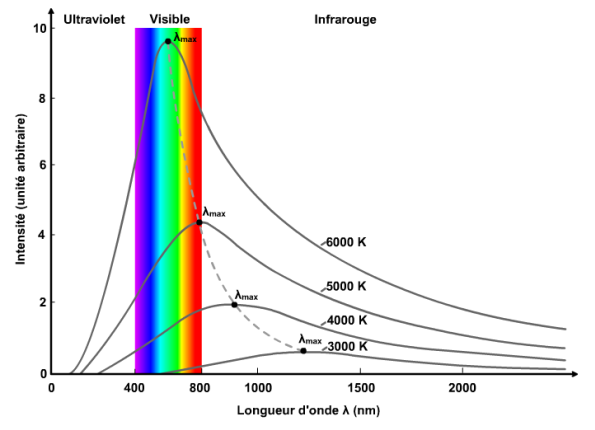
TP loi de wien
Matériel nécessaire : ordinateur portable ou éventuellement calculatrice avec tableur. (mode_emploi_simplifie_excel)
Rappels de 2nde :

Plus un corps est chaud, et plus son spectre est riche en radiations
vers le bleu et le violet.
animation sur la loi de wien : rayonnement du corps noir qui permet d’observer l’évolution du spectre en fonction de la température de surface
conversion kelvin <-> Celsius

Le DS du 16/10 pourra porter sur les 3 premiers chapitres.
- Chapitre 3 : être capable de répondre aux 3 objectifs du chapitre.
- De plus, pour le DS du 16/10, vous devrez avoir su traiter l’exercice 20 p 55 (Il n’est pas nécessaire de traiter l’exercice en entier, comparez vos réponses avec celles de vos camarades)
mercredi 17/10
séquence 4
INTERACTION LUMIÈRE-MATIÈRE
Objectif 3 : Expliquer le spectre du Soleil
Rappels de Seconde :
le spectre du Soleil :
version simplifiée…
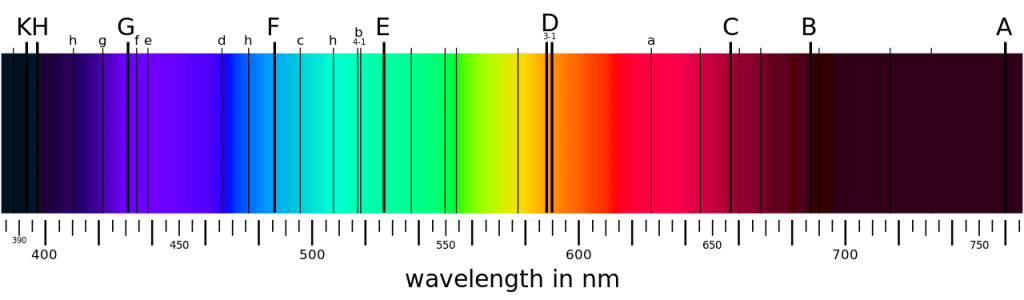
… et celui qu’on obtient avec un appareil plus précis :
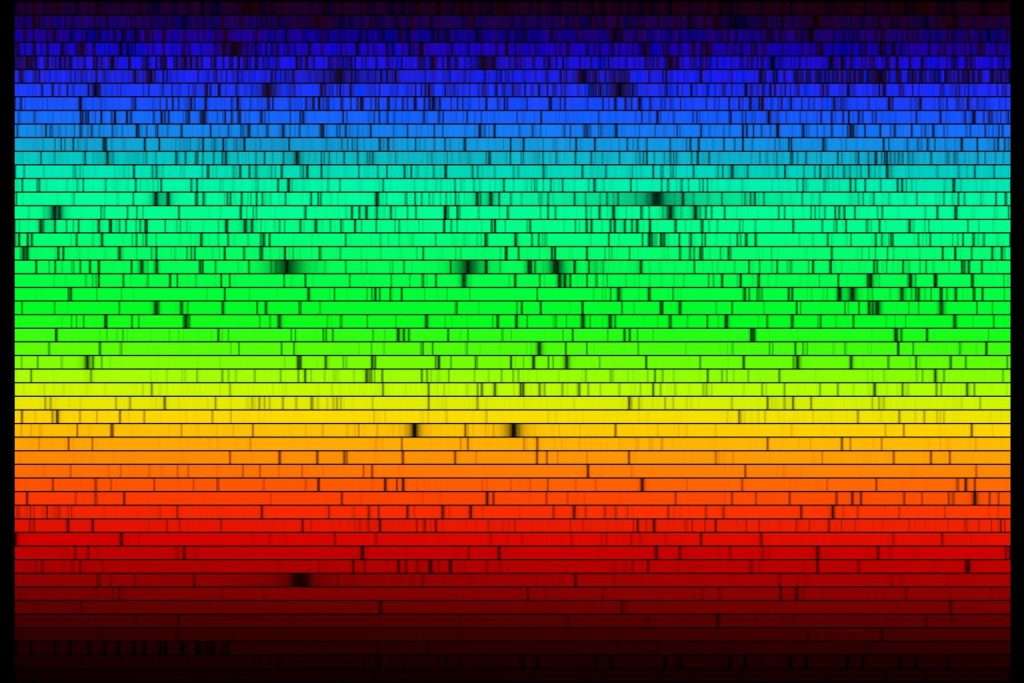
Les atomes ont des spectres caractéristiques.. Comment l’expliquer ?
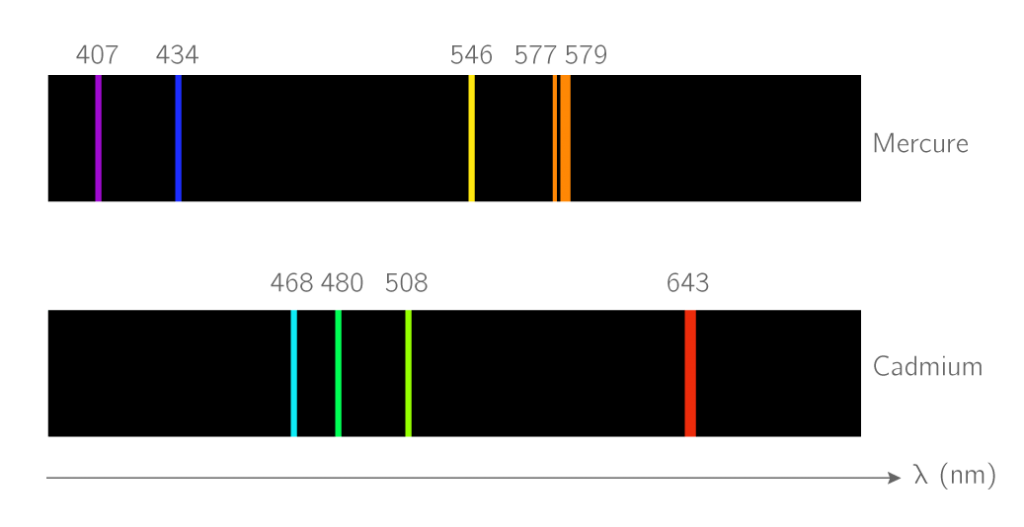
spectres d’émission et spectres d’absorption :
[swf:http://www.ostralo.net/3_animations/swf/spectres_abs_em.swf 400 300]
objectif 1 : Connaitre les échanges d'énergie entre lumière et matière
objectif 2 : Exploiter un diagramme de niveaux d'énergie
Activité : les spectres et les niveaux d’énergie
les ondes électromagnétiques couvrent un très large spectre, dont nos yeux captent une très infime partie !
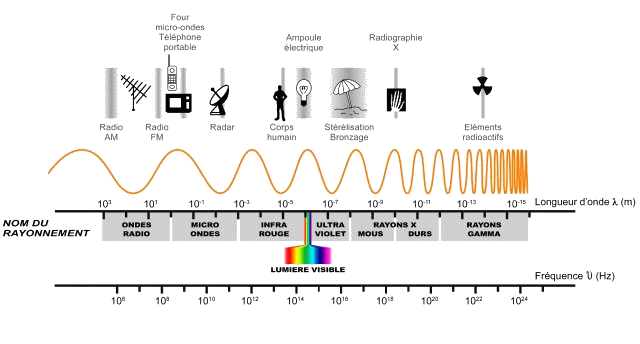
jeudi 18/10
document de cours : interaction lumière-matière
interaction-lum-matiere- correction
TP : correction partielle partie 1
TP correction partielle partie 2
(vacances de Toussaint)
Pour le mercredi 7/11
- pour les élèves partis en Grèce ou aux USA :
- revoir tous les documents distribués sur la séquence 4, refaire les activités (il y a toutes les corrections)
- Pour toute la classe :
- vous devez être capable de faire les exercices résolus (3 et 9) de la séquence 4, comme les exercices qui sont corrigés (1-6-8-13-14-22)
conseils méthodologiques
ex 12 p 67
questionnements sur le DS du jour…
jeudi 19/10
objectif 1 : Connaitre la définition d'un pigment et d'un colorant
objectif 2 : Déterminer la couleur d'un mélange des substances colorées
l'objectif 3 a été traité dans un précédent chapitre : réaliser une extraction et une séparation par chromatographie
ex 8 p 81
ex 17 p 83
mercredi 7/11
correction de l’évalutation sur la construction d’une image
correction du DS du 18/10:
jeudi 8/11
séquence 6
RÉACTION CHIMIQUE ET DOSAGE
objectif 1 : Décrire l'évolution d'un système chimique
comprendre l’avancement d’une réaction grâce à la fabrication de sandwiches au jambon

avancement_sandwichs (version pps)
avancement_sandwichs (version ppt)
document de travail : _avancement_activites
pour mercredi 14/11 : terminer la 1ère feuille du document
mercredi 14/11
correction du travail
jeudi 15/11 : pas de cours de sciences physiques.
pour mercredi 21/11
terminer le document de travail : _avancement_activites
mercredi 21/11
correction des exercices sur l’avancement_activites2_corr
jeudi 22/11
objectif 3 : Réaliser un dosage par étalonnage
Objectif 2 : Connaitre La loi de Beer-Lambert

Comment préparer une dose de V = 250 mL d’une solution d’une concentration C = 0,154 mol/L à partir d’une solution concentrée C0= 5 mol/L ? (fournie en bidons de 5 L)
En utilisant le protocole de dilution, et la relation de dilution : CoVo=C1V1 on obtient un volume v = 7,7 mL.
Mesure de l’absorbance
TP : rechercher la concentration d’une solution grâce à son absorbance
notice d’utilisation du colorimètre
protocole de dilution :
on dispose d’une solution de concentration C0. Comment préparer un certain volume v1 d’une solution de concentration C1 ?
Il faut prélever un volume v0 tel que c0v0 = c1v1
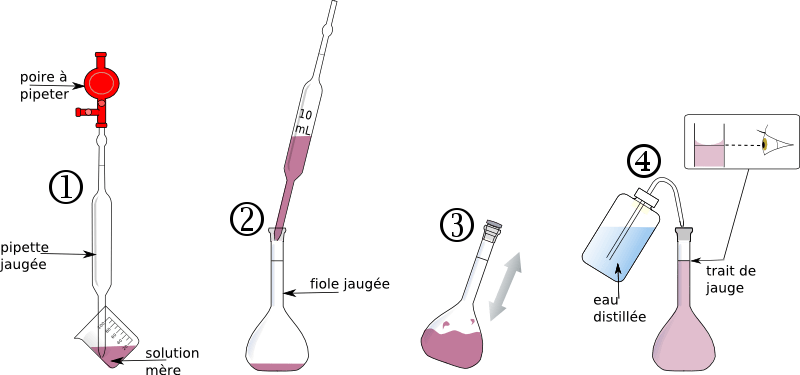
mercredi 28/11
séquence 7
GÉOMÉTRIE DES MOLÉCULES
ET VISION
objectif 1 : Établir la représentation de Lewis d'une molécule
Un lien intéressant sur la CONSTITUTION DE LA MATIÈRE
activité-cours sur la géométrie des molécules (Géométrie des molécules – chapitre 7)
bonus
- une feuille d’exercices à traiter à la maison sur le tableau d’avancement :exercices sur le tableau_d_avancement
- un DS corrigé, sur le tableau d’avancement :ds_tableau_avancement_autre
jeudi 29/11/18
Objectif 2 : Prévoir la géométrie d'une molécule simple à partir de sa représentation de Lewis.
Objectif 3 : Prévoir ou reconnaitre l'isomérie spatiale Z/E
suite et fin de l’activité-cours sur la géométrie des molécules (Géométrie des molécules – chapitre 7)
pour le mercredi 5/12/18
ex 7 et 15 p 109-110
mercredi 05/12/18
correction des exercices 7 et 15 p 109-110
chapitre 8
pour le 06/12/18 : ex 12 p 123
l’examen qui aura lieu le lundi 17/12 pourra porter sur les chapitres 4 à 7 du manuel
jeudi 06/12/18
correction de l’ex 12 p 123
les objectifs de la séquence 8 seront revus avec la partie 6...
partie 2
COHÉSION et TRANSFORMATION DE LA MATIÈRE
séquence 1
COHÉSION DE LA MATIÈRE
Objectif 1 : Décrire les constituants de la matière
activité 1 p 132
Objectif 2 : Connaitre les interactions fondamentales
Objectif 3 : Expliquer la cohésion de la matière
pour mercredi 12/12
QCM 5-10-17 p 138-139
mercredi 12/12
correction des QCM :
QCM 5 p 138
- c
- b
- a. b. e.
- b. et d.
- a. b.
QCM 10 p 138
- a et c
- c et d
17 p 140
- d
- a et d
- c
exercices 27 et 28 p 141
pour jeudi 13/12/18 : terminer les exercices 27 et 28 p 141
jeudi 13/12/18
correction des ex 27 et 28 p 141
ex 26 p 141 (l’exercice est corrigé dans le manuel)
Exercice : dans l’atome d’hydrogène, comparer la force électromagnétique et la force gravitationnelle qui lient les 2 particules
solution :
On pose :
e = 1,6.10-19 C est la charge élémentaire
mp = 1,6.10-27kg et me = 9,1.10-31 kg sont les masses du proton et de l’électron
G = 6,67.10-11m3kg-1s-2
k = 9,0.109 N.m2.C-2
R est le rayon de l’atome, et on considèrera que c’est la distance entre le noyau et l’électron.
Dans cette situation on a donc
Fk = ke2/R2
Fg = G mpme/R2
Fk /Fg = ke2/ G mpme
Le calcul donne …..2,3.1039
lien : QCM SUR LES PARTICULES ELEMENTAIRES ET INTERACTIONS FONDAMENTALES
séquence 2
LA RADIOACTIVITÉ

Objectif 1 : définir et reconnaitre l’isotopie et les isotopes
(source : ostralo.net)
Objectif 2 : expliquer les réadioactivités naturelle et artificielle.
activité sur la radioactivité : TP P2 radioac
- ex 1-2-3-4 p 152
- ex 16 p154
- ex 22 p 156
VACANCES DE NOEL
mercredi 09/01/19
correction de l’examen
LES DIFFÉRENTS TYPES DE RAYONNEMENT :
Voir l’animation Les rayonnements sur http://www.cea.fr/multimedia/Pages/animations/radioactivite/les-rayonnements.aspx
pour
LA DATATION PAR LE CARBONE 14
Voir la vidéo la datation par le carbone 14 sur http://www.cea.fr/multimedia/Pages/videos/culture-scientifique/physique-chimie/datation-carbone-14.aspx
Fonctionnement d’une centrale nucléaire (source EDF)
Lien vers la CRIIRAD (Commission de recherches et d’information indépendante sur la radioactivité) : Mars 2017, Fukushima 6 ans, un cauchemar sans fin
équations de désintégration (alpha, béta, gamma)j
Objectif 3 : Utiliser une grandeur physique : l'activité
Le DS de mardi 22/01/19 pourra porter sur :
- Partie 1 : séquences 5-6 et 7 (non, pas la séquence 8)
- Partie 2 : séquences 1 et 2
partie 1 – séquence 3
COHÉSION DES SOLIDES
Objectif 1 : Mettre en évidence une liaison polaire
objectif 2 : Expliquer la cohésion des solides ioniques
activité 2 p 161
objectif 3 : Connaitre les forces intermoléculaires
activité 3 p 162
C12_cohesion_solides_ioniques_moleculaires_TP C12_cohesion_solides_ioniques_moleculaires
vidéo : polarité des liaisons covalences et électronégativité
Les autres vidéo concernant ce chapitre se trouvent sur CETTE PAGE (en construction)
ex 3 p 167

[swf:http://www.ostralo.net/3_animations/swf/dissolution.swf 400 300]
jeudi 24/01/19
Séquence 5
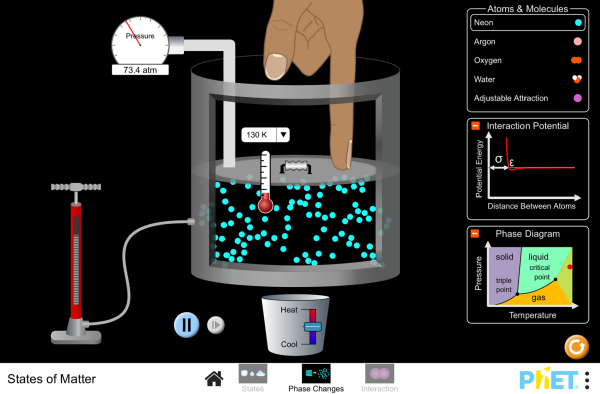
EFFETS PHYSIQUES DES TRANSFERTS THERMIQUES
objectif 1 : Connaitre les principaux effets d'un transfert thermique sur la matière
objectif 2 : Interpréter ces effets au niveau microscopique
objectif 3 : Mesurer une énergie de changement d'état
TP Mesure d’une énergie de changement d’état (p190)
pour mercredi 05/02/19
exercice 20 p 183 (voir correction, bien sur)
mercredi 30 et jeudi 31 :
pas de cours, Enseignant en formation
mercredi 06/02/2019
correction de l’activité expérimentale p 190
jeudi 07/02/2019
Q = mL et Q = mcΔt
ex 23 p 197 à terminer pour le 13/02
ex 24 p 198
correction succincte de l’ex 24 p 198
on obtient une masse m = 2,43 kg, une énergie de 240 J, une variation de -7°C, soit une température finale de 13°C.
séquence 6
ALCANES ET ALCOOLS
objectif 2 : Interpréter les propriétés physiques des alcanes et des alcools.
objectif 3 : Écrire l'équation ajustée de combustion d'un alcane ou d'un alcool.
Activités p 202 et 203
jeudi 14/02
retour et correction du DS de janvier 19
objectif 1 : Connaitre la nomenclature des alcanes et des alcools.
C13_(Exo)_molecules_organiques
C13_COURS
C13_Methode_Nomenclature
mercredi 20/02/19
objectif 3 : Écrire l'équation ajustée de combustion d'un alcane ou d'un alcool.
quelques équations de combustion à ajuster
pour vous tester : équilibrer des équations : http://www.ostralo.net/equationschimiques/
jeudi 21/02/19
ex 29 p 212
vérifier l’étiquette énergie d’un véhicule…

mercredi 13/03/2019
Le DS du 19/03 pourra porter sur les séquences 3 – 4 – 5 et 6 de la partie 2.
partie 3 : CHAMPS ET FORCES
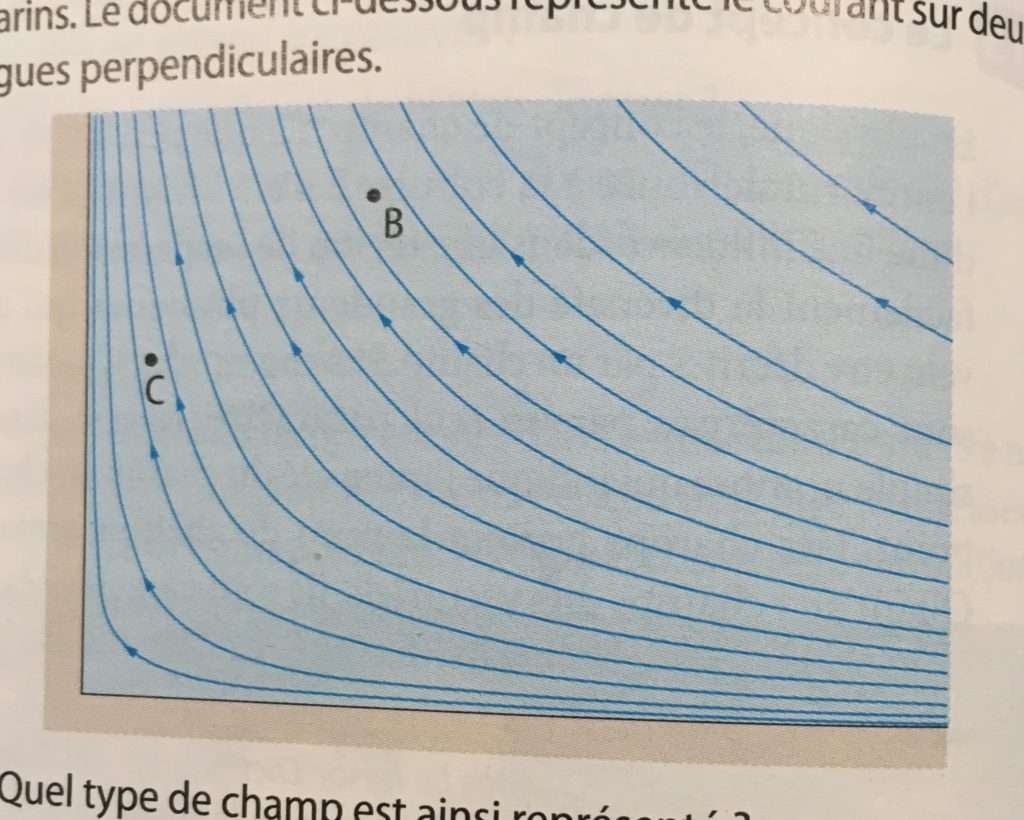
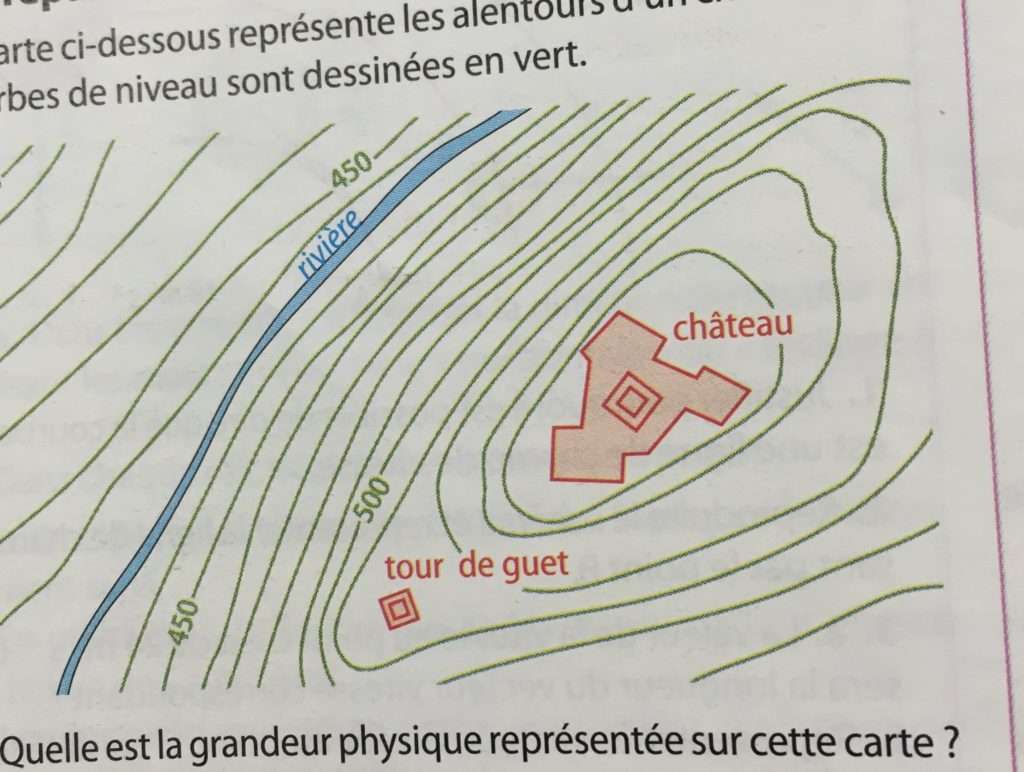
séquence 1 : Notion de champ
objectif 1 : différencier champ scalaire et champ vectoriel
activité : _notion_de_champ
(ou ACTIVITÉ P 219)
jeudi 14/03/19
objectif 2 : cartographier un champ
objectif 3 : décrire un champ
- ex 12 – 21 et 22 p 225-226-227
activité expérimentale 3 p 234 : champ électrostatique et condensateurs
mercredi 20/03/19
diaporama : champ de pesanteur
activité : le champ de pesanteur
correction des ex 12 – 21et 22 p 226
jeudi 21/03/19
5_champs_de_gravitation_pesanteur
4_notion_de_champ_historiquejeudi 28/04/19
jeudi 28/03/19
partie 4
ÉNERGIE ET PRINCIPE DE CONSERVATION
séquence 1
ÉNERGIE MÉCANIQUE
pour mercredi 03/04 : 6 et 12 p 268-69 (regarder les expressions des énergies p 267)
L’examen prévu du 8 au 12 avril 2019 pourra porter sur :
– partie 2 : séquences 3 à 6
– partie 3 : séquences 1 – 2 et 3
– partie 4 : séquence 1
mercredi 03/04/19
- correction des exercices 6 et 12 p 268-269
- exercice 20 p 270
- exercice résolu p 271
- exercice 30 p 272
(Non traité en classe cette année : Comparaison de l’énergie cinétique d’un véhicule à 90 et 80 km/h : il y a 27 % d’écart en passant de 80 à 90 km/h)
jeudi fin de la correction des exercices donnés mercredi
partie 4 – séquence 2
ÉNERGIE NUCLÉAIRE
A suivre …..
(Nous sommes à la page 275)
Objectif 1 : Utiliser les lois de conservation pour écrire l'équation d'une réaction nucléaire
Objectif 2 : Distinguer les types de réaction nucléaires
Objectif 3 : Réaliser le bilan énergétique d'une réaction nucléaire
activité sur la fission nucléaire répondre aux questions :
| le défaut de masse est Δm = 3,138200.10-28kg on en déduit ΔE = 2,8.10-11J = 175 MeV |
LES RÉACTIONS PROVOQUÉES :
FUSION ET FISSION
LA FISSION
`Voir l’animation fission sur http://www.cea.fr/multimedia/Pages/animations/radioactivite/fission.aspx
LA FUSION
Voir l’animation Réaction de fusion sur http://www.cea.fr/multimedia/Pages/animations/radioactivite/reaction-de-fusion.aspx
jeudi 09/05/19
pour le mercredi 15/05/09
exercices 2 – 5 – 9 – 13 p 282 -> 284
mercredi 15/05/09
A partir d’aujourd’hui, apportez votre manuel à chaque cours, pour avancer plus rapidement. Tout ce qui se trouve ci-dessous doit être effectué aux dates prévues.
retour sur les ex corrigés 2 – 5 – 9 – 13 p 282 -> 284 si la correction n’a pas été comprise.
projet ITER : tentative d’utilisation de la fusion nucléaire pour produire de l’énergie. (visionnage)
séquence 3
ÉNERGIE ÉLECTRIQUE
objectif : distinguer puissance et énergie
La puissance P est une grandeur instantanée. Elle indique ce que peut fournir un générateur ou consommer un récepteur à un instant donné.
La puissance électrique d’un appareil est le produit de la tension entre ses bornes et de l’intensité du courant qui le traverse.
P = U . I
P en watt (W), U en volt (V) et I en ampère
La variation d’énergie ΔE fournie ou reçue tient compte de la durée d’utilisation d’un appareil de puissance donnée.
ΔE = P . Δt
ΔE en joule (J), P en watt (W), Δt en seconde (s)
Pour obtenir ΔE en kW.h il faut exprimer P en kW et Δt en h.
objectif : Utiliser la relation liant puissance et énergie
ex 7 et 8 p 297 (voir corrigés p 470 et +)
pour le jeudi 16/05 :
terminez les exercices 7-8 p 297
jeudi 16/05/19
objectif : Exprimer la tension aux bornes d'un dipôle en fonction de l'intensité du courant électrique.
P = U. I donc U = P/I
ex 13-16 p 298
ex 25 p 300 : exercice de synthèse
partie 5
TRANSFORMER L’ÉNERGIE ET ÉCONOMISER LES RESSOURCES
séquence 1
production et transport de l’énergie électrique
Identifier les problématiques
activité p 306
Les ressources non renouvelables sont utilisées dans plus de 80 % de la production mondiale d’énergie. Elles s’épuisent car leurs durées de formation sont très supérieures à celles de l’exploitation.
Les ressources renouvelables ne s’épuisent pas lorsqu’elles sont convenablement exploitées, mais elles posent des contraintes de production (pas de stockage d’énergie et production aléatoire pour les éoliennes et les panneaux voltaïques)
Décrire l'effet Joule
Pour limiter les pertes d’énergie, le transport d’énergie électrique se fait à très haute tension.
En effet, les conducteurs possèdent une résistance, et lorsqu’ils sont traversés par un courant électrique, ils s’échauffent : c’est l’effet Joule.
De la loi d’Ohm U = R. I , on déduit l’expression :
Pj = R . I ^2
Interpréter des conversions d'énergie
voir fiche méthode 8 : établir une chaine énergétique
ex 16 p 314
Fonctionnement d’une centrale nucléaire (source EDF)
séquence 2
UTILISATION RAISONNÉE DE L’ÉNERGIE ÉLECTRIQUE
Interpréter des conversions d'énergie électrique
Un appareil électrique peut convertir l’énergie électrique en :
– énergie mécanique (ventilateur, lave-linge, moteurs électriques…)
– énergie thermique (tous les appareils chauffants)
– énergie lumineuse (lampe, téléviseur…)
– énergie chimique (chargeur de batterie)
L’utilisation raisonnée de l’énergie passe par des convertisseurs d’énergie à haut rendement.
utiliser la notion de rendement
rendement = ΔE utile / ΔE fournie
le rendement, souvent noté ρ, n’a pas d’unité.
exercices 10 et 11 p 327
Raisonner sur des systèmes électriques basse consommation
ex 14 p 328
exercice de synthèse : 17 p 329
Pour mercredi 22/05/19 : tous les exercices vus jusqu’ici doivent être faits et leur correction étudiée à l’aide du cours.
mercredi 22/05/19
séquence 3
l’énergie chimique au quotidien
Connaitre les caractéristiques énergétiques d'une combustion.
Une combustion est une réaction exothermique : toute réaction de combustion convertit de l’énergie chimique en énergie thermique.
L’énergie libérée sous forme thermique lors de la combustion d’un combustible fossile ou d’un biocarburant dépend du nombre d’atomes de carbone de la molécule constituée du combustible et de la présence d’éventuels hétéroatomes (O, N…)
Argumenter sur l'impact environnemental des combustibles.
Par ses activités industrielles et domestiques, l’Homme est la principale source de modérations des équilibres climatiques et de la pollution atmosphérique. C’est principalement l’extraction et l’usage des combustibles fossiles qui en sont responsables.
Les conséquences de ces combustions :
– l’effet de serre (principalement du au dioxyde de carbone issu de la combustion des combustibles organiques)
– les pluies acides (dues aux divers oxydes issus de combustions)

L’utilisation de la biomasse comme combustible peut permettre de réduire, dans une certaine mesure, la pollution atmosphérique.
Exploiter des informations sur le stockage et la conversion de l'énergie chimique.
Un accumulateur ou une pile stockent l’énergie électrique sous forme d’énergie chimique. (un accumulateur est vendu parfois dans le commerce sous le nom de « pile rechargeable »)
La pile à hydrogène
voir fig. 4 p 338.
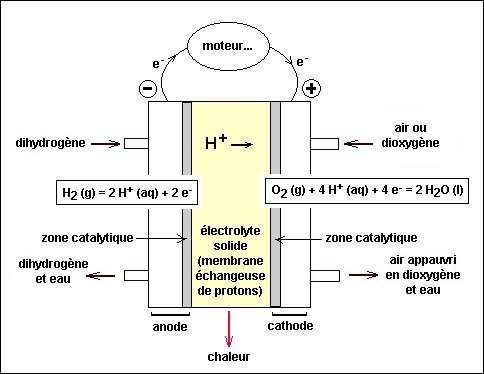
Elle est alimentée en continu en réactifs : un combustible (le dihydrogène, le méthanol…) et du dioxygène.
Capacité d’une pile :
c’est la charge électrique maximale qu’elle peut délivrer.
Q = I . Δt
Q capacité de la pile en coulomb (C)
I intensité du courant délivré en ampère (A)
Δt durée de fonctionnement en seconde (s)
La capacité peut aussi s’exprimer en ampère-heure (Ah)
L’énergie massique Wm
C’est l’énergie électrique qu’elle peut fournir, par unité de masse.
Wm = E.Q/m
avec :
Wm en J/kg
E tension de la pile à vide en V
Q en C
m en kg
Exercices 11 et 13 p 342
Pour jeudi 23/05/19 : voir toutes les notions au-dessus et faire tous les exercices jusqu’ici
jeudi 16/05/19
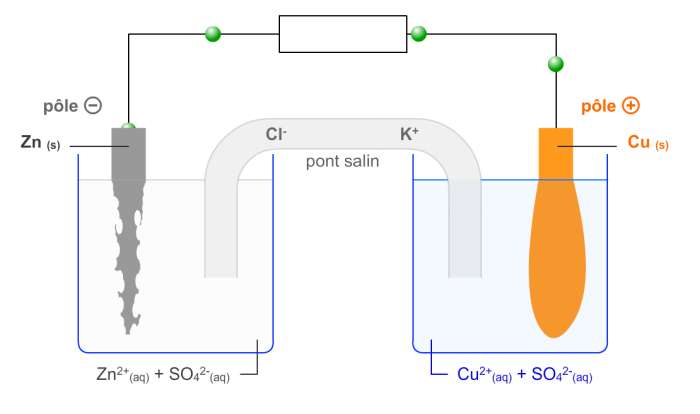
séquence 4
PILES ET OXYDORÉDUCTION
objectif 3 : réaliser une pile et modéliser son fonctionnement
objectif : définir un couple oxydant/réducteur
Espèces chimiques conjuguées :
deux espèces chimiques qui au cours d’une transformation chimique se transforment l’une en l’autre par gain ou perte d’électrons sont dites conjuguées et forment un couple oxydant/réducteur ( ou couple rédox)
L’oxydant est l’entité du couple susceptible de capter un ou plusieurs électrons.
Le réducteur est l’entité du couple susceptible de céder un ou plusieurs électrons.
exercices 2 et 5 p 354
(voir fiche méthode 13 : il faut absolument maitriser la méthode énoncée dans cette fiche)
Pour jeudi 23/05/19 : avoir avancé jusqu’ici
jeudi 23/05/19
voir correction des exercices 2 et 5 p 354-355
objectif 2 : écrire l'équation ajustée d'une réaction d'oxydoréduction
exercice 5 p 355
(voir fiche méthode 13 : il faut absolument maitriser la méthode énoncée dans cette fiche)
partie 6
CHIMIE DE SYNTHÈSE ET NOUVEAUX MATÉRIAUX
Séquence 1
Quelques familles de composés chimiques
objectif 1 : connaitre les aldéhydes et les cétones
Voir pages 367-368
Les aldéhydes possèdent un groupe -HC=O
(ce groupe est donc à l’extrémité de la chaine carbonée)
Les cétones possèdent le groupe >C =O, dans lequel l’atome de Carbone est lié lui-même à 2 autres atomes de carbone
le groupe >C=O commun aux aldéhydes et aux cétones est appelé groupe carbonyle.
Nomenclature : voir fiche méthode n°11 : Nommer les molécules organiques
ex 4 – 6 p 370
objectif 2 : connaitre les acides carboxyliques et leurs propriétés
Voir pages 367…
Les acides carboxyliques sont des molécules organiques possédant le groupe carboxyle -COOH
Nomenclature : voir fiche méthode n°11 : Nommer les molécules organiques
ex 13 – 17 p 371
objectif 3 : recueillir des informations sur la synthèse d'une molécule complexe.
Maitriser « les compétences à acquérir » p 369.
Pour mercredi 29/05 : vous devez absolument être arrivé jusqu’ici
mercredi 29/05/19
On fait le point sur l’avancée de chacun
Séquence 2
oxydation en chimie organique
objectif 1 : connaitre les réactions d'oxydation d'un alcool et d'un aldéhyde
Réactions d’oxydation ménagée :
– L’oxydation d’un alcool primaire donne un aldéhyde ou, si l’oxydant est en excès, un acide carboxylique.
– l’oxydation d’un alcool secondaire donne une cétone.
– Un alcool tertiaire ne subit pas d’oxydation.
Essayer de comprendre le mécanisme réactionnel
1) enlever deux hydrogène à la molécule d’alcool à cet endroit :
>CH-OH
2) reformer des liaisons avec les électrons célibataires libérés >C.-.O
3) constater que l’on a le groupe >C=O présent dans les aldéhydes et les cétones.
4) vérifier qu’un alcool primaire donne bien un aldéhyde, un alcool secondaire une cétone.
ex 5 p 384
Objectif 2 : Identifier des groupes d'atomes caractéristiques
Tests des composés carbonylés :
– aldéhydes et cétones réagissent avec la 2,4-dinitrophénylhydrazine (2,4-DNPH) pour former un précipité jaune.
– Un aldéhyde réagit avec :
a) la liqueur de Feeling (apparition d’un précipité rouge brique)
b) le réactif de Tollens (dépôt d’argent)
c) le réactif de Schiff (coloration rose)
ex 11 p 385
ex 14 p 385
jeudi 30/05/19 (pont de l’ascension)
Objectif 3 : Comprendre un protocole et calculer le rendement d'une synthèse
La compréhension d’un protocole est très importante…
Lors d’une synthèse, on recours très souvent à un montage de chauffage à reflux
voir et refaire l’exercice résolu 18 p 386
ex 19 p 386
ex 23 p 387
Rendement d’une synthèse : On appelle rendement le rapport de la quantité de manière d’une espèces chimiques synthétisée sur la quantité de matière maximale de cette espèce que l’on peut théoriquement obtenir.
R = n(synthétisé)/n(max)
mercredi 5 et jeudi 6/06/19
séquence 3
La chimie créatrice
Comprendre la fabrication des matières plastiques
Les polymères sont des matériaux constitués de macromolécules obtenues à partir d’une molécule de base, le monomère. Les monomères sont assemblés en longues chaines au cours de transformations chimiques appelées polymérisations.
voir fig 1 et 2 p 395
relier les propriétés d'un matériau à sa structure microscopique
On distingue les matériaux cristallins et amorphes :
Un matériau cristallin est constitué d’entités disposées régulièrement dans une structure périodique à 3 dimensions, appelées réseau.
Les matériaux amorphes sont figés, comme les solides, mais les atomes répartis de façon irrégulière les conduisent à une structure microscopiques désordonnée, comme les liquides.
Un grand nombre de matériaux ne sont ni l’un ni l’autre : on les nomme semi-cristallins.
Connaitre quelques applications de la nanochimie
survoler les activités p 392 et 393.