CAHIER DE TEXTES NUMÉRIQUE
SOMMAIRE
Introduction
CONSTITUTION ET TRANSFORMATIONS DE LA MATIÈRE
Chapitre 1 : LA MOLE
Chapitre 2 : RÉACTIONS D’OXYDORÉDUCTION
Chapitre 3 : TABLEAU D’AVANCEMENT
Chapitre 4 : TITRAGES COLORIMÉTRIQUES
Chapitre 5 : DE LA STRUCTURE À LA POLARITÉ D’UNE ENTITÉ CHIMIQUE
Chapitre 6 : COHÉSION DE LA MATIÈRE
Chapitre 7 : STRUCTURE DES ENTITÉS ORGANIQUES
Chapitre 8 : SYNTHÈSE
Chapitre 9 : RÉACTIONS DE COMBUSTION
MOUVEMENT ET INTERACTIONS
Chapitre 10 : INTERACTIONS, FORCES ET CHAMPS
Chapitre 11 : DESCRIPTION D’UN FLUIDE AU REPOS
Chapitre 12 : MOUVEMENTS D’UN SYSTÈME
L’ÉNERGIE : CONVERSIONS ET TRANSFERTS
Chapitre 13 : L’ÉNERGIE DES SYSTÈMES ÉLECTRIQUES
Chapitre 14 : ASPECTS ÉNERGÉTIQUES DES PHÉNOMÈNES MÉCANIQUES
ONDES ET SIGNAUX
Chapitre 15 : ONDES MÉCANIQUES
Chapitre 16 : LENTILLES MINCES CONVERGENTES
Chapitre 17 : COULEURS
Chapitre 18 : LUMIÈRE : ONDES ET PARTICULES
Information aux élèves (et éventuellement à leurs parents) :
Je vais vous expliquer brièvement comment nous allons travailler ensemble.
AU DELA DU PROGRAMME,
L’OBJECTIF EST
D’ACQUÉRIR DE L’AUTONOMIE,
EN CERNANT LES OBJECTIFS,
POUR POUVOIR AVANCER
À SON MEILLEUR RYTHME.
Chaque élève doit pouvoir travailler à son rythme et en fonction de ses moyens : un bilan sera établi à chaque début de chapitre pour permettre de faire le point et combler les manques éventuels ou reprendre certaines notions.
LE MANUEL :

Il faudra apporter le manuel à chaque cours. Les élèves devraient disposer du manuel numérique. A eux de choisir leur façon de s’organiser. Je préconise qu’ils laissent le manuel dans le casier du lycée et qu’ils utilisent le manuel numérique à la maison s’ils disposent du matériel nécessaire.
Dans le manuel, on retrouve tous les objectifs poursuivis au long de l’année, mais on retrouve aussi la plupart des activités et des exercices faits en classe.
Il est à noter que souvent, les élèves abordent souvent les activités et les exercices sans connaitre certaines notions : ils s’aperçoivent d’eux mêmes des outils qui leur manquent et doivent souvent aller chercher eux-mêmes des informations.
L’étude du manuel faite en classe en début d’année est primordiale.
Après présentation de la séance d’introduction, c’est l’élève qui va être capable de construire sa progression, soutenu par l’enseignant : il avancera à son rythme et doit demander de l’aide si nécessaire.

Ce parcours est le parcours minimum qui doit être effectué par chaque élève. S’il est atteint, d’autres exercices/activités lui seront fournis.
TENUE DU CARNET DE BORD/CAHIER D’ACTIVITÉS
C’est le classeur utilisé par chaque élève.
Sur chaque page doit apparaitre en en-tête :
- le thème
- le n° du chapitre et son titre
- la date du jour
- l’objectif poursuivi et
- le numéro de l’exercice ou les références de l’activité.
La progression est celle du manuel dans la mesure du possible.
En dessous de cet en-tête, l’élève consignera tout ce qu’il a fait en classe, mais notera aussi toutes les références des objectifs à retenir.
Une fois à la maison, il retrouvera les objectifs signalés dans le cahier dans son manuel. Les objectifs sont précisés en classe, ils apparaissent dans le manuel et permettent de préparer les évaluations : ce sont les choses à savoir ou à savoir faire, elles sont à connaitre.
L’UTILISATION DU MANUEL EST PRIMORDIALE : LE COURS S’Y TROUVE RÉSUMÉ, LES MÉTHODES EXPLICITÉES.
C’EST LÀ QU’IL FAUDRA SE REPORTER, CAR C’EST UN OUTIL CAPITAL.
Ceux qui ont besoin de faire des fiches pour mémoriser peuvent se servir de ces pages « l’essentiel » et les insérer dans le carnet de bord s’ils le jugent nécessaire, mais ce n’est pas obligatoire.
PRÉPARATION DES ÉVALUATIONS :
- relire attentivement le cahier d’activités/carnet de bord pour revoir les chapitres et les objectifs énoncés.
- Se plonger dans le manuel pour y retrouver les compétences nécessaires pour atteindre les objectifs.
- Refaire les activités effectuées en classe
- reprendre la méthodologie utilisée (elle apparait dans « les bons réflexes ».)
- Approfondir si nécessaire en se servant des exercices corrigés du manuel
allez, c’est parti…
Lundi 05/09/22
PARTIE 1 :
CONSTITUTION ET TRANSFORMATION DE LA MATIÈRE
Chapitre 1 : La mole
mardi 06/09/2022
obj : Déterminer la masse molaire d'une espèce à partir des masses molaires atomiques des éléments.
ex 4 p 24
Déterminer la quantité de matière d'un corps pur à partir de sa masse et du tableau périodique.
ex 6 p 24
ex 7 p 25
Correction de l’exercice 7 p 24
1. la masse molaire moléculaire de la vanilline est
M(C8H8O3) = 8 x M(C) + 8 x M(H) + 3 x m(O) donc
M(C8H8O3) = 8 x 12,0 + 8 x 1,0 + 3 x 16,0 = 152,0 g.mol-1
2. m = n x M = 2,9 x 10-2 x 152,0 = 4,4 g
ex 10 p 25
Utiliser le volume molaire de matière qu'un gaz pour déterminer une quantité de matière.
ex 14 p 26
correction des ex 4-10-14
Déterminer la quantité de matière d'un soluté à partir de sa concentration en mol.L-1 ou en g.L-1 et du volume de solution.
correction de l’exercice 29
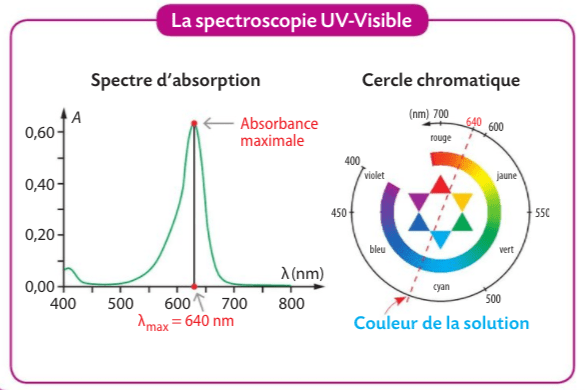
LA LOI DE BEER-LAMBERT
RAPPEL DE SECONDE :
En seconde nous avions parlé de la réalisation d’une échelle de teinte :
En 1ère, nous pouvons nous inspirer de cette façon de procéder pour trouver la concentration inconnue d’une solution, et en améliorer la précision grace à la mesure de l’absorbante et à la loi de Beer-Lambert.
C’est le moment de comprendre ce qu’est le dosage par étalonnage.
Déterminer la concentration d'un soluté à partir des mesures d'absorbance de solutions connues.
Expliquer ou prévoir la couleur d'une espèce en solution à partir de son spectre.
vidéo visionnée jusqu’à 2 min 04…
pour lundi 12/09/2022 : ex 16 p 26
lundi 12/09/2022
activité expérimentale p 13
NB : Si on utilise de la vitamine C effervescente du commerce, il faut savoir qu’un cachet qui contient 1000 mg d’acide ascorbique pèse 2,84 g (à cause de l’excipient).
Déterminer la quantité de matière de chaque espèce dans un mélange (solide ou liquide à partir de sa composition.
mardi 13/09/2022
Correction de l’exercice 16 p 26 donné mardi 06/09/2023
suite et fin de la vidéo « dosage par étalonnage »
exercice 20 p 26
exercice 22 p 27
exercice 24 p 27
exercice 29 p 28
Tous les exercices corrigés du chapitre 1 sont-ils traités ?
On termine par l’exercice 37 p 31 (attention cet exercice a été donné l’année dernière en évaluation).
pour lundi 19/09/2022 : terminer les exercices corrigés du chapitre 1
lundi 19/09/2022
Activité expérimentale p 14 : Dosage spectrophotochimique, principe et limites
(voir activité expérimentale p 14)
Proposer et mettre en œuvre un protocole pour déterminer la concentration d'une espèce colorée en solution par des mesures d'absorbance. Limites du protocole.
Capacité mathématique : Déterminer et exploiter l'équation d'une fonction linéaire.
POUR MARDI 20/09/2022 :
l’ex 37 sera considéré comme ayant été traité également en guise de travail de préparation à l’évaluation prochaine.
Mardi 20/09/2022
Questions diverses sur le chapitre 1.
Chapitre 2 :
Réactions d’oxydoréduction
objectif 3 : Identifier un couple oxydant/réducteur.
objectif 4 : écrire une demi-équation électronique.
voir méthode p 39
Pour lundi 26/09/2022 :
– exercice 2 p 43
– exercice 4 p 43
– exercice 6 p 43
– exercice 8 p 43
– exercice 9 p 43
lundi 26/09/2022
activité expérimentale 1 p 35
objectif 1 : Décrire qualitativement une réaction d'oxydoréduction.
objectif 2 : Identifier un oxydant et un réducteur.
mardi 27/09/2022
Correction des exercices donnés mardi 21/09/2021
objectif 5 : Établir l'équation d'une réaction d'oxydoréduction.
exercice 11 p 44
Espèces chimiques conjuguées :
deux espèces chimiques qui au cours d’une transformation chimique se transforment l’une en l’autre par gain ou perte d’électrons sont dites conjuguées et forment un couple oxydant/réducteur ( ou couple rédox)
autre exemple, non traité en classe, mais dont on trouve facilement la correction sur internet : écrire la demi-équation électronique liée aux deux couples H2O2/H2O et Cr2O72-/Cr3+
exercices sur le chapitre :
- (exercice 10 p 44 : on a traité cette situation en TP la veille)
- exercice 11 p 44
- exercice 14 p 44
- exercice 16 p 45
- exercice 18 p 45
- exercice 22 p 45
pour lundi 03/10/2022 : terminer la série d’exercices ci-dessus.
Pour mardi 04/10/2022 : réviser l’évaluation sur le chapitre 1.
lundi 03/10/2022
activité expérimentale 2 p 36
mardi 04/10/2022
correction des exercices du chapitre 2
ALERTE INCENDIE
1/2 équation électronique en milieu basique :
Dans une solution basique, il y a un excès d’ions HO–.
Méthode : on pose la 1/2 équation comme on a l’habitude de le faire en milieu acide, puis on ajoute des deux côtés de l’équation autant de HO– qu’il y avait d’ions H+ d’un côté. H+ et HO– donnent de l’eau.
exemple du couple Cr2O72-/Cr3+
Correction :
En milieu acide : Cr2O72- + 14 H+ + 6 e– -> 2 Cr3+ + 7 H2O
En milieu basique :
après obtention de la demi équation en milieu acide,
– on ajoute des deux côtés 14 OH–
Cr2O72- + 14 H2O + 6 e– -> 2 Cr3+ + 7 H2O + 14 HO–
– on simplifie :
14 Cr2O72- + 7 H2O + 6 e– -> 2 Cr3+ + 14 HO–
évaluation sur le chapitre 1
Lundi 10/10/2022
Chapitre 3 :
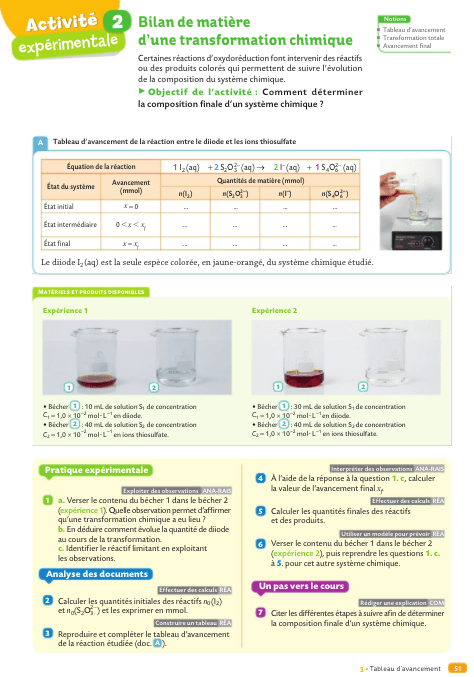
EVOLUTION D’UN SYSTEME CHIMIQUE – TABLEAU D’AVANCEMENT
comprendre l’avancement d’une réaction grâce à la fabrication de sandwiches au jambon

AvancementChimique_eleve (à traiter)
aide : avancement_sandwichs (version pps)
avancement_sandwichs (version ppt)
Objectif 1 : Décrire qualitativement l'évolution des quantités de matière des espèces chimiques lors d'une transformation.
Objectif 2 : Établir le tableau d'avancement d'une transformation chimique.
activité expérimentale :
Avancement d’une réaction chimique (activité p 50).
mardi 11/10
ex 6 p 58
correction de l’ex 6 p 58
nf(Mg) = 3,6 mmol et nf(02) = 0,8 mmol
exercice 12 p 59
Objectif 3 : déterminer la composition d'un système dans l'état final pour une transformation considérée comme totale.
Objectif 5 : Déterminer la composition de l'état final d'un système et l'avancement final d'une réaction.
Objectif 7 - Capacité mathématique : résoudre une équation du 1er degré.
pour lundi 07/11
terminer les exercices 10 – 12 – 16 p 60 – 63
puis enchainer sur les exercices 24 et 25 p 63.
————————–
VACANCES DE TOUSSAINT
————————–
lundi 07/11
mardi 08/11
On fait le point sur les exercices du chapitre 3.
Série d’exercices corrigés pour être au top sur le chapitre 3…
CORRECTION DES EVALUATIONS SUR :
– le chapitre 1
– le chapitre 2
Chapitre 4 : TITRAGES COLORIMÉTRIQUES
Relier qualitativement l'évolution des quantités de matière des réactifs et de produits à l'état final au volume de solution titrante ajoutée
code QR p 70 (livre Hachette-éducation, collection Bellier Calafell Lescure) :
Relier l'équivalence au changement de réactif limitant et à l'introduction des réactifs en proportions stoechiométriques.
Établir la relation entre les quantités de matière de réactifs introduites pour atteindre l'équivalence.
Expliquer ou prévoir le changement de couleur observé à l'équivalence d'un titrage mettant en jeu une espèce colorée.
Réaliser un titrage direct avec repérage colorimétrique de l'équivalence pour déterminer la quantité de matière d'une espèce dans un échantillon.
(cette année nous n’avons pas traité cette activité)
ex 2 p 73
ex 3 p 73
ex 4 p 73
ex 5 p 73
Lundi 14/11
activité expérimentale 1 p 66
correction de l’ex 3 p 73 :
1 : la burette est soutenue par une potence. Elle contient la solution titrante. La solution titrée se trouve dans un bécher, posé sur un agitateur magnétique (qui met en mouvement le barreau magnétique).
2. le volume VE est le volume à l’équivalence : c’est le volume de solution titrante qu’il a fallu verser pour obtenir l’équivalence, c’est à dire lorsque les réactifs sont en proportions stœchiométriques.
Correction de l’ex 5 p 73 :
1/ Parce que l’équivalence est donnée par un changement de couleur
2/ a) avant l’équivalence : photo 2 (tous les ions permanganate sont consommés, la solution est incolore)
b) après l’équivalence : photo 1 (les ions permanganate sont en excès, la solution reste rose)
(corrections des ex 2 et 4 p 73 dans le manuel)
mardi 15/11
On fait le point sur le chapitre 4.
exercice 17 p 77
Chapitre 5 :
DE LA STRUCTURE À
LA POLARITÉ
D’UNE ENTITÉ CHIMIQUE
Établir le schéma de Lewis de molécules et d'ions mono ou polyatomiques
Activité 1 p 81
pour lundi 21/11 : terminer l’activité p 81
lundi 21/11/2022
Correction succincte de l’activité 1 p 81
1. Une interaction électrostatique s’établit entre les 2 ions du fait de leur charge de signe opposé.
2.a. Dans H2, les deux atomes ne sont pas chargés, il n’y a donc pas d’interaction électrostatique. (dans le paragraphe 2).
2. b. Les électrons devraient se repousser.
3.a. et b.Il suffit de compter le nombre d’électrons de valence (ou électrons externes et de suivre les compléments scientifiques donnés dans l’activité.
Donner la représentation de Lewis des entités suivantes :
– CO2
– H20
– NH3
– Cl2
Donner la représentation de Lewis des entités suivantes :
– HO–
– NH4+
– HCO3–
vidéo : voir QR code p 86
Un atome engagé dans un ion porte une charge formelle s’il n’est pas entouré du même nombre d’électrons qu’à l’état isolé.
(on n’a pas traité l’Activité 3 p 83, ce n’était pas nécessaire)
pour l’activité 3, un lien vers le logiciel à utiliser au besoin : http://www.librairiedemolecules.education.fr/outils/scribmol/scrib.html#c
ex 16-18-19 p 93
Correction de l’ex 19 p 93
PH3 est pyramidale
HCN est linéaire
Déterminer le caractère polaire d'une liaison à partir de la donnée de l'électronégativité des atomes
Utiliser des modèles moléculaires ou des logiciels de représentation moléculaire
Interpréter la géométrie d'une entité à partir de son schéma de Lewis
mardi 22/11
Déterminer le caractère polaire ou apolaire d'une entité moléculaire à partir de sa géométrie et de la polarité de ses liaisons.
exercices 20-21 et 27 p 95
Correction des exercices 20-21-27 p 95
exercices 35-36-37 du chapitre à terminer pour lundi 28/11
lundi 28/11
INFORMATION : L’ÉPREUVE COMMUNE NE POURRA PORTER QUE SUR
LES CHAPITRES 1 À 5.
Chapitre 6 : Cohésion de la matière
activité documentaire page 100.
Expliquer la cohésion de la matière au sein de composés solides ioniques et moléculaires par l'analyse des interactions entre entités.
mardi 29/11
Expliquer la capacité de l'eau à dissocier une espèce ionique et à solvater les ions.
Modéliser au niveau macroscopique la dissolution d'un composé ionique dans l'eau par une équation de réaction en utilisant les notations (s) et (aq).
source : http://chimie.ostralo.net/dissolution/
Modéliser au niveau macroscopique la dissolution d'un composé ionique dans l'eau par une équation de réaction en utilisant les notations (s) et (aq).
– lire l’essentiel p 108
– exercices 4-6-8 p 112
correction des ex 4-6-8 p 112-113
exercices 10 – 12 – 13 – 14 p 112-113
Correction des exercices 10 – 12 – 13 – 14 p 112-113
Calculer la concentration des ions dans la solution obtenue.
Expliquer ou prévoir la solubilité d'une espèce chimique dans un solvant par l'analyse des interactions entre les entités.
Comparer la solubilité d'une espèce solide dans différents solvants
Expliquer le caractère amphiphile et les propriétés lavantes d'un savon à partir de la formule semi-développée de ses entités. Citer des applications usuelles de tensioactifs. Illustrer les propriétés des savons.
Pour lundi 12/12 : les 2 derniers exercices 26 et 27 p 117 peuvent être traités.
Ce chapitre est quasi terminé. Tout ce qui concerne l’extraction liquide-liquide sera traité lundi 12/12.
Lundi 05/12 :
épreuve commune de sciences physiques
semaine du 05/12 au 09/12 :
épreuves communes de 1ère
lundi 12/12
Interpréter un protocole liquide-liquide à partir des valeurs de solubilités de l'espèce chimique dans les deux solvants.
Choisir un solvant et mettre en oeuvre un protocole d'extraction liquide-liquide
Activité expérimentale p 103
mardi 13/12
Correction des exercices 10 – 12 – 13 – 14 p 112-113
Correction succincte de l’Exercice 13 p 113 :
1/ n(K+) = [K+] x V0 = 15 x 10-3mol
2/ n0 = ⅓ n(K+) d’après les coefficients de l’équation de dissolution.
Donc n0 = 5,0 x 10-3 mol
3/ m0 = n0 xM(K3SO4) = 5,0 x 10-3 x 212,3 = 1,06 g
On fait le point sur les derniers exercices du chapitre 6 : 26 et 27 p 117
Chapitre 7 :
Structure des entités organiques
Identifier à partir d'une formule semi-développée les groupes caractéristiques associés aux familles de composés.
activité 1 p 120
Justifier le nom associé à la formule semi-développée de molécules et inversement
Pour mardi 03/01 :
– terminer l’activité p 120
– exercices 5-7-9-10 p 130-131
————————–
VACANCES DE NOËL
————————–
mardi 03/01/2023
Correction de l’évaluation commune
retour si nécessaire sur :
11 p 130-131
ex 12 p 130
voici la 2e partie du chapitre sur la spectroscopie.
Exploiter à partir de valeurs de références un spectre d'absorption infrarouge.
ex 13 – 14 p 130-131
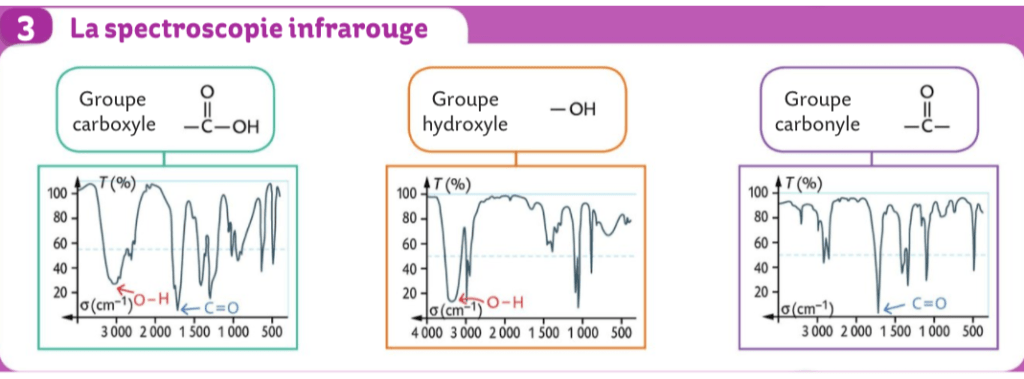
pour lundi 09/01 : terminer les ex 11 – 12 – 13 – 14 p 130-131
mardi 10/01
Correction des exercices 11 – 12 – 13 – 14 p 130-131
exercice 16 p 131
Correction de l’exercice 16 p 131
E a pour formule brute C2H4O2.
On observe sur le spectre une bande forte et large située entre 2600 et 3200 cm-1 : cette molécule possède une liaison C-O, celle de l’acide carboxylique.
On observe sur le spectre une bande fine et forte située entre 1700 et 1760 : cette molécule possède une double liaison C=O.
Cette molécule est donc de l’acide éthanoique, ou acide acétique CH3-COOH.
Activité p 121
Pour lundi 16/01
– exercices 17-18-24-25 p 132-135
– terminer l’activité p 121
Lundi 09/01 et lundi 16/01
Pour des raisons organisationnelles, nous traiterons aujourd’hui une activité expérimentale en rapport avec le chapitre 8 avant d’avoir terminé le chapitre 7.
Sur cette page, les dates s’intercaleront pour que les chapitres ne se mélangent pas.
Chapitre 8 : SYNTHÈSE
Le montage du chauffage à reflux, utilisé pour la synthèse.
Activité expérimentale p 140
Justifier, à partir de données, le choix de méthodes d'isolement, de purification ou d'analyse.
Schématiser et légender des dispositifs expérimentaux utilisés lors d'une synthèse.

mardi 17/01
retour sur le chapitre 7.
identifier et nommer les différentes étapes de la synthèse d'une espèce chimique
ex 10 p 149
exercices 8 et 9 p 148
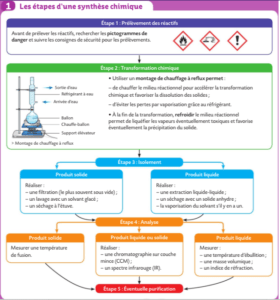
Analyser un produit en réalisant une chromatographie sur couche mince ou en mesurant une température de changement d'état
exercice 16 p 150
Déterminer le rendement d'une synthèse
exercice 18 p 150
exercice 20 p 150
exercice 12 p 149
EXERCICES DE SYNTHÈSE du chapitre 8 :
exercice 22 p 151
exercices 27 et 28 p 153
UNE ÉVALUATION EST PRÉVUE
LE 31/01.
ELLE POURRA PORTER SUR
LES CHAPITRES 5 À 8.
Lundi 23/01
Chapitre 9 :
RÉACTIONS DE COMBUSTION
Écrire la réaction de combustion complète d'un alcane et d'un alcool .
voir p 158 pour support visuel.
exercices 3 p 164 et 4 p 164
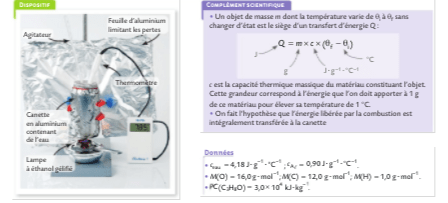
Mettre en œuvre une expérience pour estimer le pouvoir calorifique d'un combustible.
ÉNERGIE TRANSFÉRÉE LORS D’UNE COMBUSTION
Q = n Ecombustion
l’énergie molaire de combustion est l’énergie transférée lors de la combustion d’une mole de combustible. Ecombustion < 0
Q = -m x PC
Le PC est le pouvoir calorifique, c’est à dire l’énergie que l’on peut récupérer lors de la combustion d’un kilogramme de combustible. PC >0
mardi 24/01
on fait le point sur le chapitre 8.
Les exercices d’entrainement demandés (qui sont corrigés dans le manuel) doivent être faits, comme d’habitude.
Estimer l'énergie molaire de réaction pour une transformation en phase gazeuse à partir de la donnée des énergies de liaisons.
exercice 7 p 164
ex 8 p 164
activité 2 p 157
Citer des applications usuelles qui mettent en œuvre des combustions et les risques associés.
Citer des axes d'étude actuels d'applications s'inscrivant dans une perspective de développement durable.
Citer des exemples de combustibles
lundi 30/01
Correction de l’exercice 8 p 164
1. le méthane, le butane, le fuel, le bois, les granulés de bois.
2. C3H8 (g) + 5 O2 (g) → 3 CO2 (g) + 4 H2O (g)
3. Nombre de liaisons :
| Liaisons rompues | Liaisons formées |
| 8 C-H 2 C-C 5 O=O | 6 C=O 8 O-H |
4. Ecomb = 8 El(C-H) +2 El(C-C) + 5 El(O=O) – 6 El(C=O) – 8 El(O-H)
donc Ecomb = 8 x 413 +2 x 348 + 5 x 496 – 6 x 796 – 8 x 463
soit Ecomb = – 2000 kJ.mol-1
Correction de l’activité 2 p 157
1. la masse de CO2 qui s’accumule chaque année dans l’atmosphère est estimée à 15,5 Gt
2. Les rayons lumineux traversent l’atmosphère.
L’énergie solaire est absorbée par la Terre. Les IR émis par le réchauffement sont prisonniers de l’atmosphère, puisque 80 % des rayons émis reviennent sur Terre. Ce qui explique le réchauffement.
C’est ce qu’on nomme « l’effet de serre », par allusion à ce qui se passe dans une serre de culture.
3. Le rendement est de 0,9.
D’après les équations de synthèse de l’urée, cela implique que
n(urée produite) = 0,9 x n(CO2) et que
n(CO2) = n(urée produite) /0,9
On calcule n (urée) = production mondiale d’urée/M(urée) = 167.106/(60.10-6)
On trouve n(CO2) = 3,0 x 1012 mol
On en déduit m(CO2) = 3,0 x 1012 x 44 = 132 x 10 12 g
donc m(CO2) = 132 Mt
exercices 9 et 10 p 165
exercices corrigés 11-12-16-17 du chapitre (p 165-167)
2e PARTIE :
MOUVEMENTS
ET
INTERACTIONS
Chapitre 10 :
INTERACTIONS, FORCES ET CHAMPS
Caractériser localement une ligne de champ électrostatique ou de gravitation.
Utiliser l'expression vectorielle des forces de gravitation et électrostatique et celle des champs correspondants.
Citer des analogies entre la loi de Coulomb et la loi d'interaction gravitationnelle.
Vidéo p 179 : Cartographier un champ
Interpréter des expériences mettant en jeu l'interaction électrostatique.
exercices 3-4 p 184
exercices 5-6 du chapitre 10
lundi 06/02
activité 2 p 176

Caractériser localement une ligne de champ électrostatique ou de gravitation.
Analogies et différences entre champ de gravitation et champ électrostatique :

mardi 07/02 évaluation
pour lundi 13/02 :
– exercices 7- 8 – 9 – 12 p 184-185.
lundi 13/02 : correction des exercices, fin du chapitre 10.
correction des exercices 8-12 p 184-185.
SUITE DU CHAPITRE : ex 17-19-20-31-32 du chapitre à terminer
Utiliser la loi de Coulomb.
correction des ex 17-19-20-31-32 du chapitre
mardi 14/02 : début du chapitre 11
Chapitre 11 :
DESCRIPTION D’UN FLUIDE AU REPOS
Mais… quel volume d’air (à la pression atmosphérique de 1 bar) peut-on faire rentrer dans une bouteille de 15 L à une pression de 200 bars ?
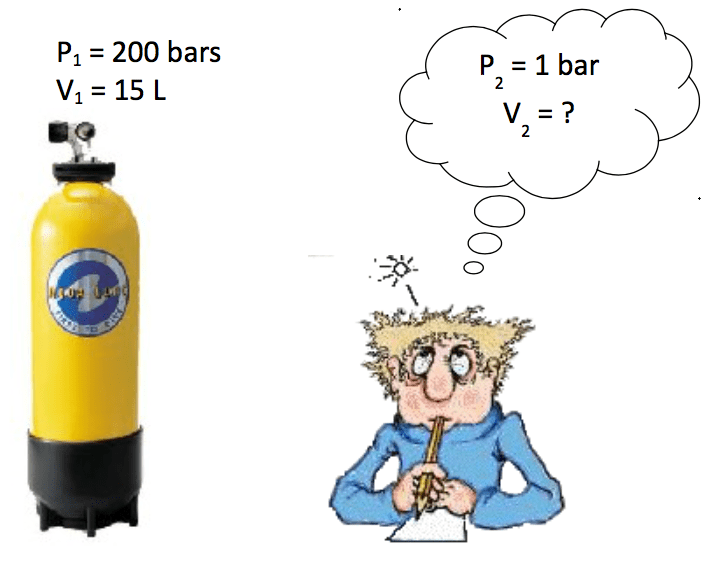
Loi de Mariotte :
A température constante et à quantité de matière constante, le produit de la pression P d’un gaz par le volume V qu’il occupe est constant :
P x V = constante
Dans l’exemple précédent on trouve v = 3000 L
exercice 19 p 205
exercices 18 – 20 p 205
Expliquer qualitativement le lien entre les grandeurs macroscopiques de description d'un fluide et le comportement microscopique des entités qui le constituent.
ex 2 et 4 p 204
Exploiter la relation F = P x S pour déterminer la force pressante exercée par un fluide sur une surface plane S soumise à la pression P.
Relation entre pression et force pressante :
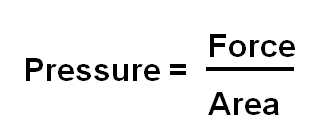
Dans le cas d'un fluide incompressible au repos, utiliser ou tester la relation fondamentale de la statique des fluides fournie : PB - PA = ρ x g x (zA - zB)
À noter :
Si la température d’un fluide est en lien avec l’agitation des entités, la pression d’un fluide est liée au nombre de chocs des entités contre les parois, par unité de temps.
Pour lundi 06/03 :
– terminer les exercices 31 et 32 p 191 du chapitre 10
– terminer les exercices 37 et 38 p 211 du chapitre 11
————————–
VACANCES D’HIVER
————————–
lundi 06/03 : TP loi de mariotte
Utiliser ou tester la loi de Boyle-Mariotte, par exemple en utilisant un dispositif comportant un microcontroleur
mardi 07/03 : retour évaluation – suite et fin du chapitre 11
Exercice 23 p 206
Exercice 26 p 206
Exercice 37 p 206
Exercice 38 p 206
Tous ces exercices sont à terminer pour mardi 14/03 prochain.
Pour lundi 13/03 : début du chapitre 12
Chapitre 12 :
MOUVEMENTS D’UN SYSTÈME
Capacité mathématique : sommer et soustraire des vecteurs.
Utiliser la relation approchée entre la variation du vecteur vitesse d'un système modélisé par un point matériel entre deux instants voisins et la somme des forces appliquées sur celui-ci : - pour en déduire une estimation de la variation de vitesse entre deux instants voisins ; - pour en déduire une estimation des forces appliquées au système, le comportement cinématique étant connu.
Activité documentaire p 215 à terminer pour lundi 13/03
lundi 13/03 et mardi 14/03
activité expérimentale :
Réaliser et exploiter une vidéo ou une chronophotographie d'un système modélisé par un point matériel en mouvement pour construire les vecteurs variation de vitesse.
ETUDE DU MOUVEMENT D’UN OBJET
(L’étude du mouvement se limite à l’intervalle pendant lequel la balle n’est en contact ni avec la personne ni avec la poubelle, c’est à dire uniquement pendant la chute.)
La somme des forces appliquées au système
(la 2e loi de Newton)
Dans un référentiel donné, si un système de masse m constante est soumis à une ou plusieurs forces constantes, le vecteur variation de vitesse Δv pendant la durée très courte Δt et la somme vectorielle de ces forces sont reliés de façon approchée par la relation :
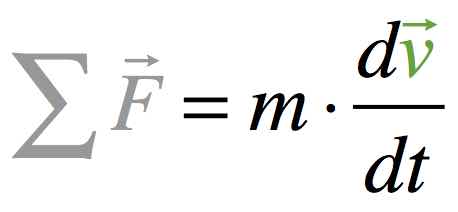
ΣF et Δv (ou dv) sont colinéaires et de même sens.
Quizz p 221.
exercices 6 et 8 p 225.
l’exercice 10 p 226
SITUATION PROBLÈME :
Imaginons un objet qui ne serait soumis qu’à son poids… c’est à dire un objet en l’air, mais qu’il n’y aurait pas d’air autour de lui….
Pourriez-vous dans ce cas prévoir son accélération ?

DONC….une plume et un marteau tomberaient à la même vitesse sans l’influence de l’air… ?
…
…
…
Correction de l’exercice 22 p 229
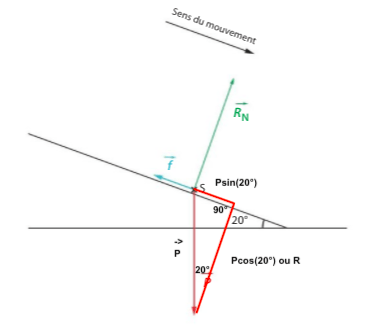
Le skieur se déplaçant à vitesse constante, on doit avoir une somme vectorielle nulle des forces extérieures.
Cela implique que la composante du poids projetée sur la piste soit égale à la force de frottements.
2 méthodes mathématiques :
- avec les sinus : on calcule f = P x sin(20°).
- avec le théorème de pythagore : P2= R2+ f2 donc on peut calculer f2 = P2 – R2 et obtenir f.
Exercice 25 p 231
lien : PAGE COMPLETE SUR LA MÉCANIQUE (depuis la 5e)
EVALUATION MARDI 28/03 : ELLE POURRA PORTER SUR LES CHAPITRES 9 – 10 – 11 – 12
Lundi 20/03 : révisions sur ces chapitres.
mardi 21/03 :
3e PARTIE
L’ÉNERGIE :
CONVERSIONS ET TRANSFERTS
Chapitre 13 :
L’énergie des systèmes électriques
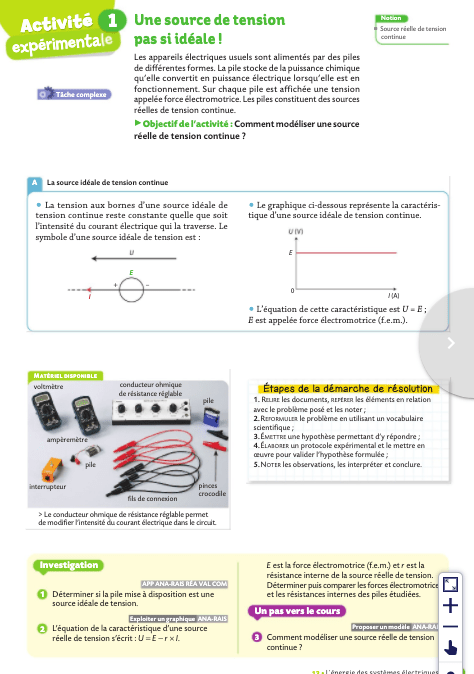
Relier intensité du courant continu et débit de charges.
Expliquer quelques conséquences pratiques de la présence d'une résistance dans le modèle d'une source réelle de tension continue.
Déterminer la caractéristique d'une source réelle de tension et l'utiliser pour proposer une modélisation par une source idéale associée à un conducteur ohmique.
Citer quelques ordres de grandeur de puissances fournies ou consommées par des dispositifs courants.
Définir et évaluer le rendement d'un convertisseur.
capacité mathématique : déterminer l'équation d'une fonction affine.
correction des exercices 22 et 25 du chapitre 12
exercice 3 p 248
exercice 5 p 248
exercice 6 p 248
exercice 7 p 248
exercice 8 p 248
correction 6 p 248
1. U = E – rI
2. U = 12,0 – 0,01 x 25,0 = 12 – 0,25 = 11,75 V
exercices 12-13 p 249
exercices 16-17 p 250
correction 13 p 249
1. U = 4,5 V et I = 0,050 A, donc Pélect = U x I = 0, 225 W
2. nM = Pméc / Pélect = 0,20 / 0,225 = 0,89
correction 16 p 250
On cherche la charge déplacée :
Q = I x Δt = 150 x 10-12 x 9 x 3600 = 4,86 x 10-6 C
On calcule le nombre d’électrons n :
n = Q/e = 4,86 x 10-6 / 1,60 x 10-19 = 3,00 x 1013
correction 18 p 250
1. la source est modélisée par une source réelle de tension continue.
2. Ce sont les lignes 6 et 7.
3. Il faut insérer :
après la ligne 7 : rendement=Psortie/Pentrée ou rendement=E/I
et il faut insérer après la ligne 10 : print(« Le rendement vaut r= »,rendement, ». »)
lundi 27/03
Chapitre 14 :
Aspects énergétiques des phénomènes mécaniques
rappel de 4e :
Émécanique = Écinétique + Épotentielle
activité p 256 :
– Réactiver ses connaissances : répondre aux questions
– Flash test : répondre aux questions
Correction page 256
- Au début de la vidéo, la bille n’a pas de vitesse intiale. Son énergie cinétique est donc nulle. Par contre, elle est lachée d’une certaine hauteur : elle possède donc de l’énergie potentielle (énergie de position).
- Lors de la descente de la bille, la hauteur de la bille diminue mais sa vitesse augmente : il y adonc conversion d’énergie potentielle en énergie cinétique.
- Lors de la remontée de la bille, la vitesse de la bille diminue au fur et à mesure qu’elle remonte : il y a conversion d’énergie cinétique en énergie potentielle.
- On peut considérer que l’énergie de la bille est conservée puisqu’elle remonte.
Aïe, il y a un problème : si la bille conserve son énergie, alors elle doit remonter à la même hauteur de l’autre coté. Ce n’est pas le cas.
FLASH TEST p 256
- L’énergie cinétique d’un véhicule est donnée par la formule Ec = ½ m x v2.
Elle est proportionnelle à sa masse et au carré de sa vitesse, donc réponse C. - L’énergie cinétique d’un cycliste est Ec = ½ m x v2.
Ec = ½ x 60 x 102 = 3000 J = 3,0 x 103 J donc réponse A. - réponse B et réponse C
- réponse A.
activité documentaire p 257
théorème de l’Énergie cinétique – travail d’une force
le travail d’une force F sur le déplacement AB est donnée par le produit scalaire de ces deux vecteurs. Il va falloir réinvestir ce que vous avez vu en Maths.
Allez voir le cours p 261.
Utiliser l'expression de l'énergie cinétique d'un système modélisé par un point matériel.
ex 4 p 268
mardi 28/03 : évaluation chap. 9-10-11-12
lundi 03/04
Utiliser l'expression du travail WA->B(F) = F.AB dans le cas de forces constantes.
ex 6 p 268
ex 7 p 268
correction de l’ex 7 p 268
a. W < 0
b. W = 0
c. W > 0
d. W < 0
e. W > 0
tout dépend du signe du cos de l’angle formé par les vecteurs F et AB.
Énoncer et exploiter le théorème de l'énergie cinétique.
ex 8 p 268
Établir et utiliser l'expression de l'énergie potentielle de pesanteur pour un système au voisinage de la Terre.
Utiliser la variation (conservation ou non-conservation) de l'énergie mécanique.
(Cette vidéo commence de la même manière que la précédente, mais elle aborde un autre théorème, vous allez voir)
Voilà, vous êtes désormais capable d’évaluer la vitesse, lorsqu’elle va toucher le sol, de la bombe à eau que vous laissez tomber du 4e étage. :)
Utiliser un dispositif pour étudier l'évolution des énergies cinétique, potentielle et mécanique d'un système dans différentes situations.
Activité 2 p 258.
La conservation de l’énergie mécanique permet par exemple de prévoir la vitesse du pendule au point le plus bas, à partir de la hauteur à laquelle il est caché.
Calcul du travail d’une force :
ex 18 p 270
exercices corrigés sur le chapitre 14 :
exercice 8 p 269
exercice 16 p 269
exercice 21 p 270
mardi 04/04
Ces deux corrections sont à étudier soigneusement.
4e PARTIE
ONDES ET SIGNAUX
Chapitre 15 :
ONDES MÉCANIQUES
(On reprend les notions de l’ancien programme de seconde sur la période et la fréquence. On ne parlera ici que des ondes mécaniques, c’est à dire des ondes qui se propagent dans un milieu matériel. Les ondes électromagnétiques ne sont donc pas abordées dans ce chapitre.)
Cette vidéo est capitale dans la compréhension de ce qu’il y a à savoir ou à savoir faire, dans le cadre de cette continuité pédagogique à distance. Je n’y vois rien d’utile à ajouter, pour le moment.
Décrire et expliquer la propagation d'une perturbation mécanique dans un milieu matériel.
Produire une perturbation et visualiser sa propagation.
ex 3 p 294
On parle de célérité d’une onde : c’est la vitesse de propagation de l’onde.
ex 7 p 294
ex 8 p 294
à visionner : la maquette pédagogique du museum d’histoire naturelle du Havre.
Déterminer la période, la longueur d'onde et la célérité d'une onde progressive sinusoïdale à l'aide d'une chaine de mesure.
Capacité numérique : simuler à l'aide d'un langage de programmation, la propagation d'une onde périodique.
Capacité mathématique : utiliser les représentations graphiques des fonctions sinus et cosinus.
Déterminer par exemple à l'aide d'un microcontroleur ou d'un smartphone une distance ou la célérité d'une onde.
exercices 15 et 17 p 295 (faciles) puis …
exercices 31-32 p 300
l’ex 34 p 301 est très typé bac, il peut être interessant de le traiter.
L’ex 35 ressemble beaucoup à l’ex 32, SAUF que le graphique donne la durée en abscisse et non la distance, et cela a son importance.
lundi 10/04 : lundi de Pâques
mardi 11/04 : on fait le point sur les exercices du chapitre 15 (31-32-34 p 300-301)
mardi 11/04 :
on fait le point sur les derniers exercices du chapitre.
Certains élèves étaient absents à la dernière évaluation. Elle sera rendue le 17/04.
Chapitre 16
LENTILLES MINCES CONVERGENTES
Nous allons essayer tout de même de nous mettre à jour à travers les animations suivantes. Attention, elles sont parfois en flash et sur certains téléphones et tablettes, elles apparaitront difficilement. Essayez de changer de navigateur (safari, Firefox, Opera, Chrome ou Microsoft Edge, qui n’est parfois pas si mauvais).
Si vous avez une loupe à la maison, prenez la, vous pourrez l’utiliser régulièrement, cela vous aidera, c’est une lentille mince convergente.

Le plus important est de savoir comment trouver l’image d’un objet graphiquement. Il faudra ensuite être capable de retrouver mathématiquement cette position et les caractéristiques de l’image en effectuant une addition de fractions (relations de conjugaison et de grandissement)
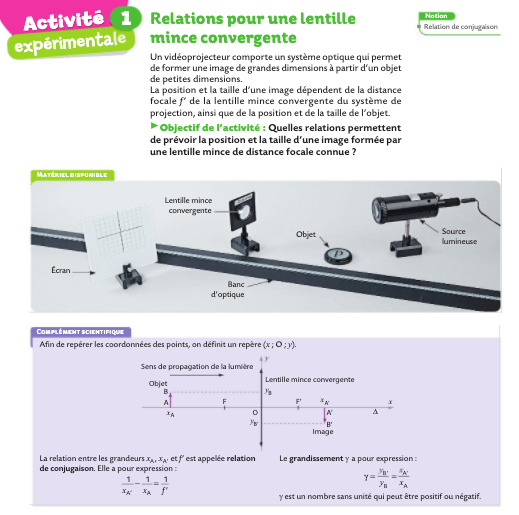
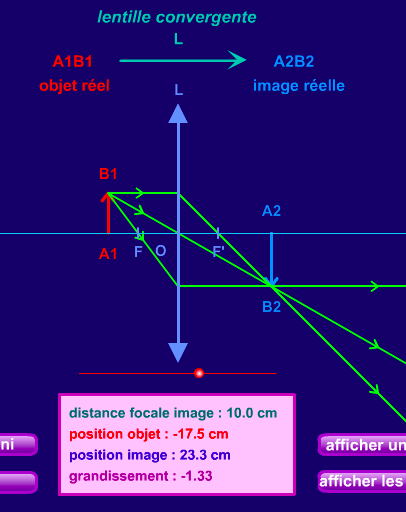
Comment se forme l’image d’un objet par une lentille mince convergente ?
formation d’une image sur un écran
Vous pouvez jeter un oeil sur l’exercice 3 p 314.
Estimer la distance focale d'une lentille mince convergente.
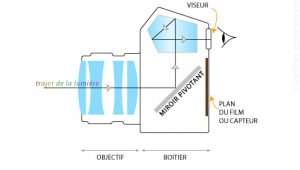
animation : mise au point d’un appareil photo (attendez un peu que l’animation charge…)
Déterminer les caractéristiques de l'image d'un objet-plan réel formée par une lentille mince convergente.
Pour construire l’image d’un objet à travers une lentille , on peut tracer 3 rayons (en réalité, 2 suffisent) qui vont se croiser :
– Le rayon (rouge) qui passe par le « foyer image » F ressort après la lentille parallèle à l’axe (en pointillés).
– Le rayon bleu qui passe par le « centre optique » O n’est pas dévié.
– Le rayon vert parallèle à l’axe optique est dévié après la lentille.
L’objet est AB, l’image est A’B’.
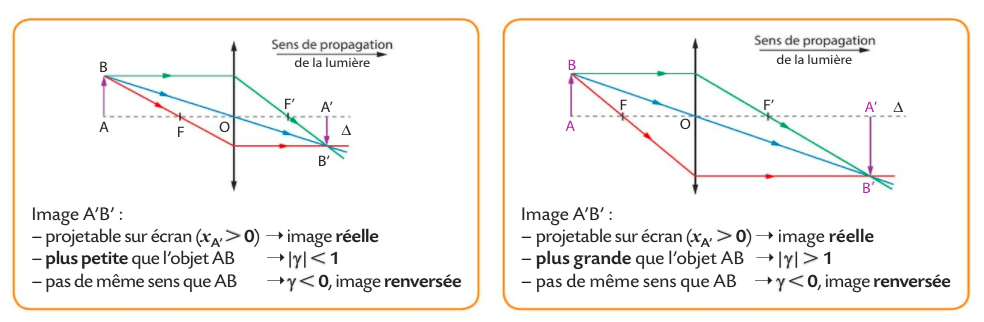
exercice 14 p 315
exercice 15 p 315
Tester la relation de conjugaison d'une lentille mince convergente.
Attention à respecter les règles mathématiques, j’ai constaté les années précédentes de nombreuses erreurs de signes, de calculs sur ces sommes de fractions…
RELATION DE CONJUGAISON
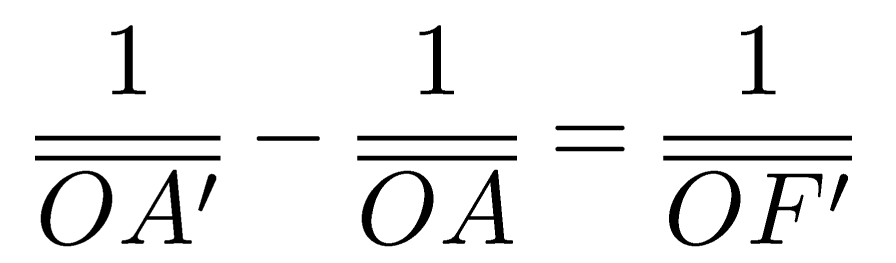
exercice 16 p 316
Exploiter les relations de conjugaison et de grandissement fournies pour déterminer la position et la taille de l'image d'un objet-plan réel.
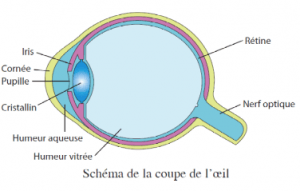
(On utilise souvent l’exemple de l’oeil et son modèle simplifié : on représente l’oeil par une lentille convergente et un écran)
Capacités mathématiques : Utiliser le théorème de Thalès. Utiliser des grandeurs algébriques.
RELATION DE GRANDISSEMENT
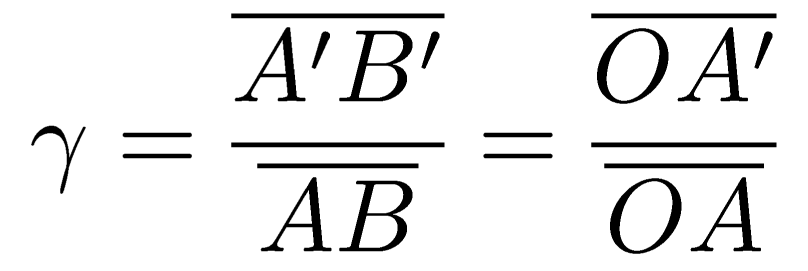
exercice 17 p 316, et vérifier par le calcul (en utilisant les relations de conjugaison et de grandissement) que vous retrouvez bien les valeurs données par la construction graphique de l’ex 17.
Attention aux erreurs de signe sur les valeurs algébriques et aux erreurs de calculs sur ces additions/soustractions de fractions !
Exercice 28 p 319
Pour confirmer les résultats par le calcul, il faut reprendre les formules. Si vous trouvez un résultat différent de celui de la construction géométrique, c’est que vous faites une erreur de calcul/raisonnement mathématique.
lundi 17/04
NB : 3a. Évaluation de l’incertitude-type (de type B) sur la distance focale : Évaluer la distance maximale dont peut être déplacée la lentille de part et d’autre de la position obtenue, tout en conservant l’image nette. Cette distance sera considérée comme égale à l’incertitude-type u(f ′) sur la distance focale.
3b. la distance focale donnée avec une précision de 2 % par le fabricant.
mardi 18/04
Retour de l’évaluation donnée le 28/03
Chapitre 17
COULEURS
Dans ce chapitre, nous allons constater que :
- toutes les couleurs peuvent être produites à partir d’un nombre restreint de couleurs : cela tient au fait que nos yeux possèdent seulement 3 types de capteurs pour ce qui est des couleurs (voir programme de SVT)
- il y a deux types de synthèse de couleurs : la synthèse additive et la synthèse soustractive : la synthèse additive concerne l’addition de sources lumineuses, la synthèse soustractive concerne la filtration de lumière.
NB : il y a plusieurs animations flash sur ce chapitre. essayez d’utiliser un appareil (tablette, ordi ou téléphone) et un navigateur compatibles.
La perception des couleurs est assurée par 3 types de cônes, sensibles respectivement aux couleurs bleue, vert et rouge.
ANIMATION :
SYNTHÈSE ADDITIVE
SYNTHÈSE SOUSTRACTIVE
Dans la synthèse additive, il s’agit d’additionner des sources de lumière colorées.
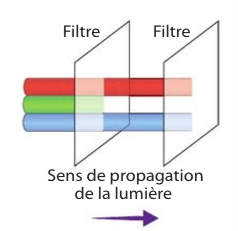
Dans la synthèse soustractive, on filtre la lumière avec plusieurs filtres superposés.
Vous pouvez essayer de manipuler les spots (synthèse additive) et le filtres (synthèse soustractive) dans l’animation ci-dessous.
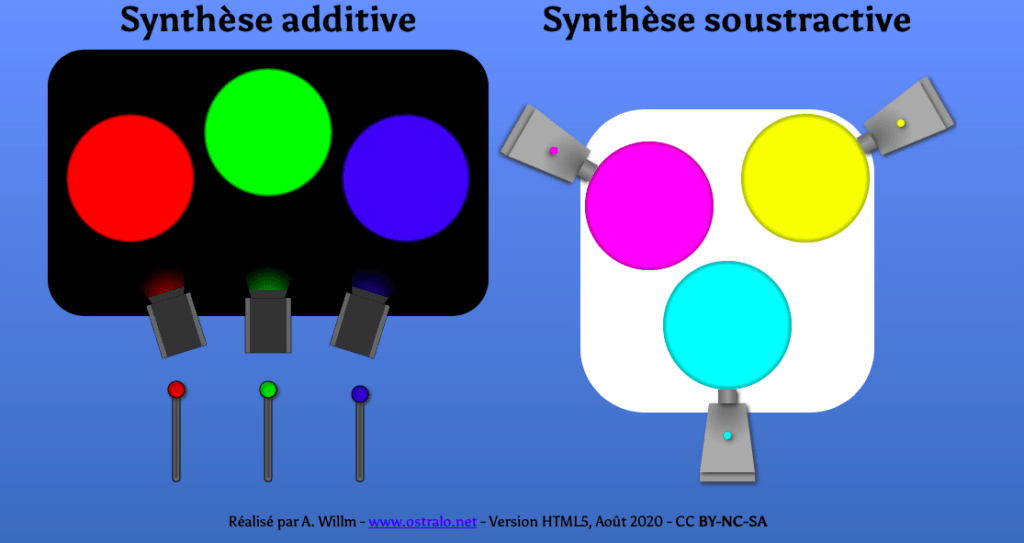
| la synthèse additive : les ronds symbolisent les lumières projetées sur un fond blanc (qui est noir lorsqu’il n’est pas éclairé, bien sur) | la synthèse soustractive : on fixe le soleil ou une source de lumière, et on place devant la lumière des filtres. (C’est la synthèse utilisée en peinture et pour les filtres colorés de lumière) |
On retrouve donc les schémas des pages 324 et 325.
TOUT LE TRAVAIL CI-DESSOUS EST À FAIRE POUR LE MARDI 9/05 PUIS LE LUNDI 15/05.
Choisir le modèle de la synthèse additive ou celui de la synthèse soustractive selon la situation à interpréter.
Illustrer les notions de synthèse additive, de synthèse soustractive et de couleur des objects.
Pour vérifier que vous avez compris : QCM p 327.
Interpréter la couleur perçue d'un objet à partir de celle de la lumière incidente ainsi que des phénomènes d'absorption de diffusion et de transmission.
Synthèse additive :
exercices 3-4-5-6 p 330
correction de l’ex 4 p 330
C’est la synthèse additive : on additionne les lumières.
correction de l’exercice 6 p 330
Pour obtenir du magenta, il faut du rouge et du bleu.
Prévoir le résultat de la superposition de lumières colorées et l'effet d'un ou plusieurs filtres colorés sur une lumière incidente.
exercice 9 p 330
exercice 10 p 330
ex 14 p 331
exercice 19 p 332
.
Sur ce chapitre, comme à chaque fois qu’on parle de synthèse de couleur, il faut garder en tête ces schémas :
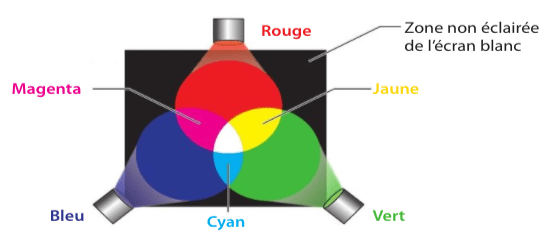
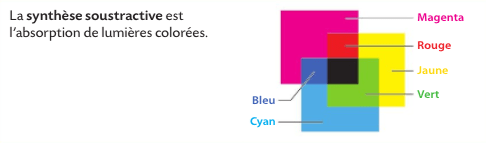
exercice 25 p 333
…
exercice 27 p 334 : la lumière noire.
EXERCICES À RENDRE EN LIGNE PAR ECOLE DIRECTE :
– POUR LE 9/05 :
Exercice 10 p 330
Exercice 14 p 331
– POUR LE 15/05 :
Exercice 25 p 333
Exercice 28 p 334
Exercice 29 p 334
Attention : Aucun travail ne sera accepté par messagerie mais il sera à déposer sur en suivant si nécessaire le tutoriel suivant par ordinateur ou avec son téléphone.
————————–
VACANCES DE PRINTEMPS
————————–
MARDI 9/05 : parution des corrections des exercices 10 et 14
Correction de l’exercice 10 p 330
Le rouge et le bleu associés donnent du magenta en synthèse additive. Le filtre qui laisse passer le magenta est…. MAGENTA.
Un filtre qui ne laisse passer ni le rouge ni le bleu est VERT.
(visuel de l’exercice 10 p 330)
Correction de l’exercice 14 p 331
Lorsqu’elle est éclairée par de la lumière blanche, la pomme est jaune.
La lumière jaune renvoyée par la pomme est composée de rouge et de vert. (voir schémas du cours sur la synthèse additive ou soustractive).
Si on éclaire la pomme avec de la lumière verte, elle ne peut renvoyer que de la lumière verte.
lundi 15/05 : parution des corrections des exercices demandés sur ecoledirecte
Correction de l’exercice 25 p 333
- La couleur perçue d’un objet dépend :
– de la lumière incidente qui l’éclaire
– des lumières colorées qu’il absorbe, diffuse et transmet. - Un objet blanc peut diffuser les lumières colorées rouge, bleue et verte.
- Il est jaune orangé.
- Un objet bleu ne renvoie que du bleu. S’il n’en reçoit pas, il n’en diffuse pas et apparait donc noir.
- Cette objet est éclairé par toutes les radiations du spectre lumineux (même si c’est de faible intensité vers le rouge).
correction de l’exercice 28 p 334
- Lorsqu’il est éclairé par de la lumière blanche, le crayon est cyan. Cela signifie qu’il renvoie le mélange des lumières vert et bleu.
Éclairé de rouge, il ne renvoie pas de lumière.
Éclairé de vert, il renvoie du vert. - L’écran blanc apparait jaune car le jaune est le résultat de la synthèse additive du rouge et du vert.
- Justifier la couleur des ombres à l’aide d’un schéma : l’ombre rouge du crayon est la partie de l’écran non éclairée par le vert et l’ombre verte du crayon est la partie de l’écran non éclairée par le rouge. Il y a donc sur l’écran des ombres du crayon décalées car les deux spots, 1 rouge et 1 vert, sont légèrement décalés.
correction de l’exercice 29 p 334
- ce sont les batonnets qui sont les récepteurs les plus sensibles à la lumière : ce sont ceux dont le seuil de sensibilité est le plus bas.
- Lorsqu’il y a peu d’intensité lumineuse, les cônes S, M et L, sensibles à la couleur, ne détectent pas la lumière et ne transmettent donc pas d’information.
- On repère les longueurs d’onde où le seuil de détection est le plus bas : Les cones S sont les plus sensibles aux bleu, les cônes M au vert et les cônes L au rouge.
- ce sont les batonnets qui sont les récepteurs les plus sensibles à la lumière : ce sont ceux dont le seuil de sensibilité est le plus bas.
- Lorsqu’il y a peu d’intensité lumineuse, les cônes S, M et L, sensibles à la couleur, ne détectent pas la lumière et ne transmettent donc pas d’information.
- On repère les longueurs d’onde où le seuil de détection est le plus bas : Les cones S sont les plus sensibles aux bleu, les cônes M au vert et les cônes L au rouge.
lundi 15/05 et mardi 16/05
Chapitre 18
LUMIÈRE : ONDES ET PARTICULES
Rappels de Seconde :
Voici quelques documents que vous avez peut-être déja étudiés l’année dernière, vous pouvez aussi aller voir les animations, ou alors passer directement à la vidéo de 1ère.
le spectre du Soleil :
version simplifiée…
… et celui qu’on obtient avec un appareil plus précis :
les ondes électromagnétiques couvrent un très large spectre, dont nos yeux captent une très infime partie !
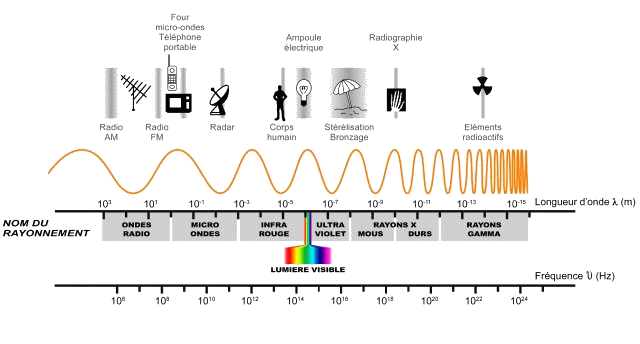
activité p 339
Correction succincte de l’activité 1 p 339
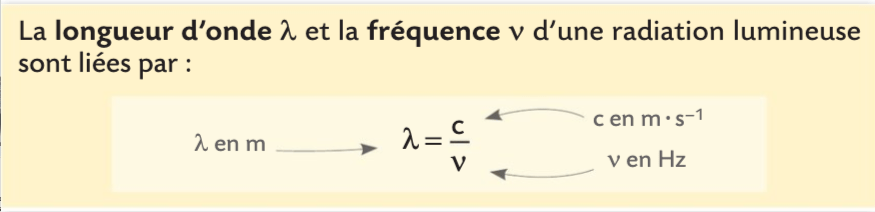
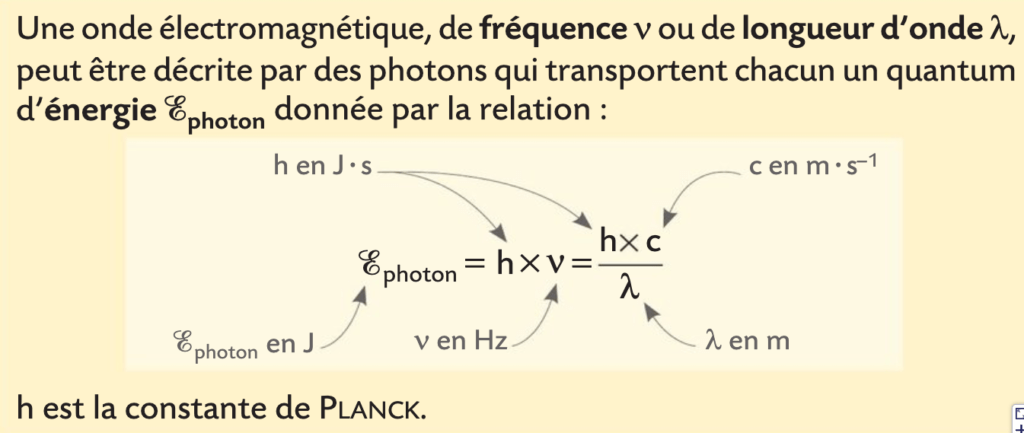
Cette relation, appelée relation de PLANCK-EINSTEIN montre la nature à la fois particulaire (par le déplacement de particules de masses nulles appelées photons) et ondulatoire (une onde qui possède une fréquence et une longueur d’onde ) de la lumière.
On parle de dualité onde-particule.
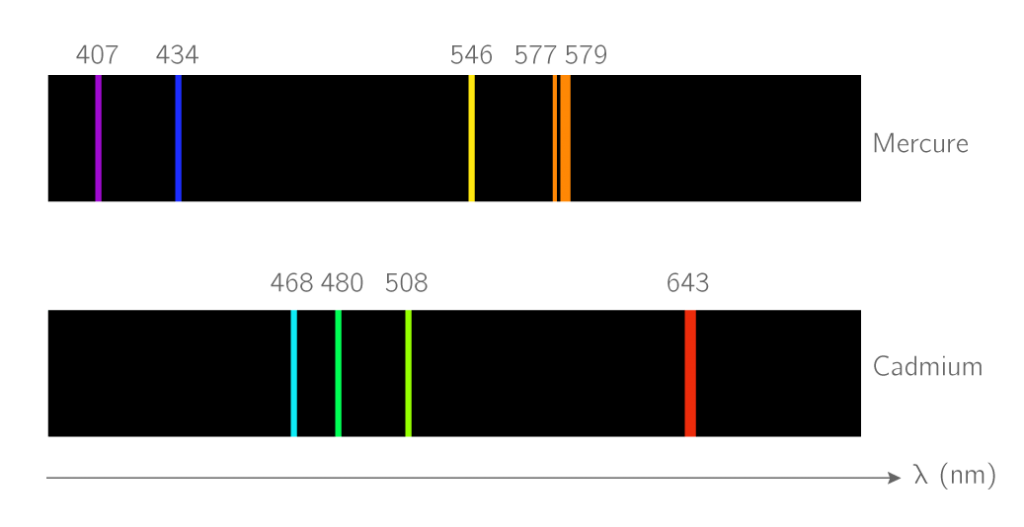
Les atomes ont des spectres caractéristiques.. Comment l’expliquer ?
pour lundi 22/05 : exercices 3 – 5 – 7 – 9 p 349
Lundi 22/05 : vous traiterez l’activité p 340 avec Mme STRUB.
mardi 23/05 fin du programme de physique-chimie
mardi 23/05
Correction des exercices 3-5-7-9 p 349
exercice 12 p 349
exercice 13 p 349
exercice 15 p 349
exercice 26 p 352.
Correction de l’exercice 26 p 352
Méthode 1 : On lit sur le spectre d’émission les longueurs d’onde des raies.
On trouve λ. On en déduit ΔE en J puis en eV.
On cherche alors si la transition électronique correspondant à cette variation d’énergie peut se trouver dans le tableau.
Méthode 2 : Le document 2 donne les valeurs en eV des transitions électroniques.
Pour savoir si les transitions d’énergie en eV donnent les radiations du document 1 il faut convertir E en eV en J (On sait que 1 ev = 1,60 x 10-19J.) puis chercher les valeurs de λ correspondant.
(Dans le principe, on reprend le même raisonnement que l’exercice résolu p 347)
Ainsi, la transition ε1->2= ε1 -> ε2 a pour valeur ε1->2=13,6-3,39=10,21 eV
On convertit en J :
ε1->2= 10,21 x 1,60 x 10-19 = 16,34 x 10-19J = 1,63 x 10-18J
D’après le document 3, l’absorption de certaines radiations est due aux gaz qui entourent l’étoile.
On calcule λ :
ε1->2 = hc/λ donc λ = hc/ε1->2
λ = 6,63 x 10-34 x 3,0 x 108/(1,63 x 10-18)
= (6,63 x 3,0/1,63) x (10-34 x 108/10-18)
= 12,2 x 10-8m
donc λ = 122 nm pour la transition 1->2
Pour les autres transitions : il est recommandé de recourir à un tableur.
FIN DU PROGRAMME DE L’ENSEIGNEMENT DE SPÉCIALITÉ DE PHYSIQUE CHIMIE
Bas de page